Réplication du virus de l`hépatite C dans les cellules immunitaires

Mini-revue
Réplication du virus
de l’hépatite C
dans les cellules immunitaires
Cyrille Féray
Institut des Maladies de l’Appareil Digestif, Hôtel-Dieu, 44 000 Nantes
Le virus de l’hépatite C (VHC) infecte les cellules immunes présentes
dans les ganglions et le sang comme l’atteste la présence d’antigè-
nes viraux, d’intermédiaires de réplication et de variants spécifi-
ques dans ces sites extra-hépatiques. Ces variants compartimentés
pourraient intervenir dans la réponse à l’interféron et les syndromes
lymphoprolifératifs liés au VHC. Etablir les déterminants virologi-
ques du tropisme extra-hépatique du VHC devrait éclairer le
mécanisme de son tropisme hépatocytaire.
Mots clés : virus de l’hépatite C, tropisme cellulaire
Le tropisme cellulaire des virus est rarement unique. Ainsi le virus de
l’immunodéficience humaine (VIH) a un tropisme pour les lympho-
cytes T et pour les macrophages ; le virus de l’hépatite B infecte
évidemment les hépatocytes mais aussi les lymphocytes sanguins. En ce
qui concerne le virus de l’hépatite C (VHC), la possibilité d’une infection
extra-hépatique a été débattue pendant longtemps. Les cellules lympho-
cytaires et monocytaires ont été de loin les plus étudiées mais d’autres
types cellulaires comme les épithéliums digestifs ou biliaires [1] ou les
cellules hématopoïétiques ont été impliqués [2]. Il semble certain, à ce
jour, qu’il existe une réplication du VHC dans les lymphocytes et les
monocytes sanguins périphériques et ganglionnaires [3]. La question
essentielle est celle du rôle de cette infection extra-hépatique dans
l’histoire naturelle ou thérapeutique du VHC.
Problématique globale
Le fait de détecter l’acide ribonucléique (ARN) du VHC dans un type
cellulaire donné ne signifie pas que la réplication existe dans ce type
cellulaire. En effet, les virions présents dans le plasma peuvent être
absorbés par les tissus ou les cellules étudiés par des récepteurs plus ou
moins spécifiques. La réplication du VHC nécessite la présence d’un ARN
viral positif dans le cytosol, la traduction des protéines virales dont la
polymérase virale qui permettra la synthèse d’un brin ARN complémen-
taire (dit brin négatif), matrice obligatoire pour la synthèse d’ARN
génomique (brin positif). Enfin, en supposant la réalité de la traduction et
de la réplication de l’ARN viral, une question est celle de la production de
particules virales complètes ou défectives par ces cellules. Dans tous les
Hépato-Gastro, vol. 13, n° 5, septembre-octobre 2006
Tirés à part : C. Féray
347
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

cas, de l’interaction plus ou moins spécifique entre
virions et membrane cellulaire jusqu’à l’existence d’un
cycle viral complet, toute une série d’interactions peu-
vent être envisagées.
Arguments pour une réplication
du VHC dans le système immunitaire
Arguments cliniques
Il existe une prévalence accrue de lymphomes non
hodgkiniens (LNH) dans certaines populations infec-
tées par le VHC. Une observation majeure [4] est que
le traitement par interféron-alpha permet d’obtenir une
réponse antitumorale et antivirale chez des patients
porteurs de LNH et infectés par le VHC alors qu’il est
inefficace pour des LNH similaires survenant chez des
patients indemnes d’infection VHC. Cette observation,
confirmée ultérieurement, suggère fortement un rôle
direct du VHC dans la survenue de certains LNH et
donc l’infection de tissus immunitaires par le VHC.
Un autre argument est la persistance de l’ARN du VHC
dans les lymphocytes et monocytes sanguins (LMS)
chez des patients ayant une réponse virologique pro-
longée après traitement par interféron alpha [5].
Détection extra-hépatique
des protéines virales
L’immunomarquage des protéines VHC a été peu uti-
lisé en raison de la variabilité des souches VHC et de
problèmes de sensibilité, la réplication du VHC étant
considérée comme faible même dans le foie [6]. Une
étude récente [3] démontre clairement la présence de
grandes quantités de protéines virales dans les gan-
glions lymphatiques du pédicule hépatique. Alors que
l’immunomarquage sur les LMS est peu contributif, la
concentration des lymphocytes et des monocytes dans
ces ganglions drainant la source de réplication virale
majeure permet d’obtenir une quantité suffisante de
cellules infectées et donc d’antigènes viraux pour une
détection fiable. Ainsi, l’infection des LMS par le VHC
ne reflète qu’une faible partie de l’infection du système
immun par ce virus.
Détection extra-hépatique du brin négatif
La détection usuelle du brin négatif se fait par reverse-
transcriptase suivie d’une PCR. Elle pose un problème
paradoxal : en présence de nombreux brins positifs, la
possibilité de détection artefactuelle du brin négatif par
amorçage intermoléculaire augmente. Inversement, en
présence d’une faible quantité de brins positifs, le
nombre de brins négatifs est bas et la détection du brin
négatif quoique plus spécifique est plus difficile. Ceci
explique les résultats paradoxaux de la littérature, les
brins négatifs pouvant être détectés dans le plasma où
ils sont théoriquement absents comme absents de tissus
hépatiques où ils sont obligatoires. Ces discordances
expliquent pourquoi l’idée d’une réplication extra-
hépatique du VHC a été longue à s’imposer [6]. En
dépit de ces divergences nettes et des très diverses
méthodes utilisées, le tableau 1 qui compile tous les
cas étudiés dans la littérature montre que le brin négatif
est plus souvent détecté dans les LMS que dans le
plasma.
Une autre méthode est l’hybridation in situ utilisée
récemment [3]. Cette approche n’est pas exposée aux
artefacts de la PCR et montre que les adénopathies du
pédicule hépatique en cas d’hépatite chronique VHC
abritent de grandes quantités d’intermédiaires de répli-
cation. Une fois de plus, les résultats sont convaincants
en raison de la quantité et de la concentration de
génomes viraux.
Cultures cellulaires
Certaines lignées lymphocytaires semblent pouvoir, in
vitro, abriter une réplication virale mais avec une
production virale faible et incertaine. Plus intéressante
est la possibilité de cultiver des lymphocytes [7], des
monocytes, voire des cellules lymphomateuses obte-
nues de sujets chroniquement infectés. La stimulation
des lymphocytes T semble pouvoir autoriser une répli-
cation à long terme et le surnageant pouvoir infecter
des cellules naïves d’infection.
La compartimentation réplicative
du VHC
L’ARN polymérase du VHC est incapable de corriger
les erreurs de réplication. Chez un sujet infecté par le
VHC, il existe un mélange de variants plus ou moins
proches définissant la nature « quasi-espèce » de ce
virus. Cette distribution de la quasi-espèce a été étu-
diée essentiellement dans le plasma. Le phénomène de
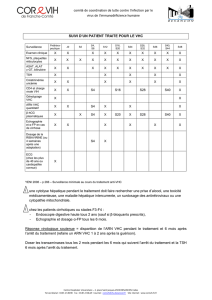
compartimentation virale décrit une composition de la
Tableau 1.Résumé de la littérature concernant la détection
du brin négatif de l’ARN VHC dans plus d’un compartiment
(sérum, lymphocytes-monocytes sanguins,
tissus hématopoïétiques), entre 1992 et 2005
(Gaetana Di Liberto, thèse de Sciences, 2006).
Compartiment Nombre
de publications
Nombre
de patients
%decas
de détections
de brin négatif
Plasma/sérum 74 416 18 %
Foie 27 173 91 %
LMS 81 652 33 %
Moelle osseuse 21 44 28 %
Mini-revue
Hépato-Gastro, vol. 13, n° 5, septembre-octobre 2006
348
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

quasi-espèce différente suivant le site de détection de
l’ARN viral. Les premiers papiers utilisant le clonage-
séquençage des variants et des méthodes statistiques
adaptées démontraient que cette répartition n’étaient
pas aléatoire entre plasma et lymphocytes sanguins
(figure 1) [8]. L’existence de cette compartimentation
milite contre l’absorption non spécifique de particules
virales circulantes et suggère la réplication, dans ces
sites, de variants adaptés. Les différences nucléotidi-
ques de certains variants détectés dans les LMS peu-
vent être tout à fait importantes.
Trois études récentes [9-11] montrent que 10 à 25 %
des patients étudiés abritaient dans leurs LMS un géno-
type indétectable dans le plasma. Cette coinfection
particulière, que nous appelons compartimentation
génotypique, est plus fréquente chez les ex-usagers de
drogue, population connue pour être exposée à des
contacts répétés et donc à des souches diverses. Il
n’existe pas d’étude de la compartimentation, c’est-à-
dire de la diversité virale pour d’autre sites potentiels
de réplication tels les épithéliums digestifs ou biliaires.
Types cellulaires abritant
une réplication extra-hépatique
in vivo
Les travaux utilisant l’approche des brins négatifs et
ceux abordant la question de la compartimentation par
étude des séquences virales détectées dans différents
compartiments pointent clairement vers une infection
privilégiée des lymphocytes B et des monocytes/
cellules dendritiques. La charge virale semble plus
élevée dans ces deux types cellulaires que dans les
CD8 ou les CD4. Dans notre expérience, il peut exister
dans les CD8, des variants très distants à la fois des
variants plasmatiques et des variants retrouvés dans les
lymphocytes B ou les monocytes.
L’étude de la compartimentation des régions hyperva-
riables démontre qu’il existe chez tous les patients
étudiés (n = 14) des souches spécifiques des lympho-
cytes B ou des monocytes et parfois des deux types
[12]. Le phénomène de compartimentation semble
donc général lors de l’infection chronique par le VHC
(figure 2).
Origine des variants plasmatiques
Le foie est un compartiment paradoxalement assez peu
étudié. Il apparaît que la quasi-espèce trouvée dans le
foie et celle détectée dans le plasma sont différentes.
Néanmoins, les études ayant abordé ce type d’étude
phylogénétique ne démontrent pas que ces différences
sont significatives. D’autre part, lors de l’hépatite C, il
existe une importante infiltration lymphocytaire et
monocytaire du foie qui complique la question. Enfin,
la comparaison entre ARN viral hépatique et ARN viral
circulant n’est pas réellement correcte. L’ARN contenu
dans le plasma est celui de virions soumis à des
pressions de sélection autres que l’ARN viral infectant
des tissus. Ces derniers peuvent abriter, en théorie, des
variants défectifs incapables d’un site réplicatif com-
plet. La durée de vie des hépatocytes permettrait de
détecter ces variants indétectables dans le plasma.
Dans quelques cas de compartimentation génotypi-
que, nous avons pu étudier plasma, LMS et foie et
avons observé que les génotypes plasmatiques et
hépatiques étaient identiques et que l’on pouvait retrou-
ver des traces de génotypes lymphocytaires dans le
foie, peut-être en raison de l’infiltration du foie par les
LMS [10]. Dans ce type de situation, les variants
plasmatiques sont beaucoup plus proches des variants
hépatiques que des variants lymphocytaires suggérant
que les souches plasmatiques sont très majoritairement
d’origine hépatocytaires.
.1.1.1.01
75
7
LMS
plasma
Figure 1.Arbre phylogénétique des variants définis dans la région
hypervariable du VHC et détectés dans les LMS et le plasma.
Hépato-Gastro, vol. 13, n° 5, septembre-octobre 2006 349
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Enfin, lors de l’hépatectomie totale obligatoire pendant
une transplantation hépatique, il existe une diminution
très forte de la charge virale plasmatique. Néanmoins,
dans cette situation, les modèles de cinétique virale
prédisent, l’existence d’un compartiment extra-
hépatique contribuant à près de 4 % de la charge
virale plasmatique [13].
Les mécanismes
de la compartimentation
L’adaptation d’une souche virale à un type cellulaire
peut faire intervenir théoriquement différentes étapes
(figure 3). La première est celle des récepteurs membra-
naires, comme CD81 ou DC-SIGN qui sont exprimés à
la surface de la plupart des cellules lymphocytaires ou
monocytaires. Il n’existe pas de données actuellement
en faveur de mutations dans le gène de l’enveloppe
virale pouvant conditionner le tropisme cellulaire. Une
seconde étape est l’adaptation de la région non tra-
duite ou zone d’entrée du ribosome (IRES) présente à
l’extrémité non-codante du génome viral. Une seule
mutation de l’IRES virale peut modifier l’efficacité tra-
ductionnelle dans un type cellulaire donné et une
observation suggère que l’IRES des variants présents
dans les cellules dendritiques a une efficacité traduc-
tionnelle basse [14]. Enfin, la réponse immune, humo-
rale ou cellulaire, pourrait exercer une pression de
sélection différente suivant les types cellulaires expri-
mant les antigènes viraux. C’est ce que suggère l’étude
des pressions de sélection déduites de l’analyse des
séquences de l’enveloppe qui indique des ratios muta-
tions synonymes/mutations non synonymes significati-
vement plus bas pour les variants infectant les LMS que
pour ceux détectés dans le plasma [12].
Les conséquences
de la réplication extra-hépatique
La première question est celle d’un réservoir de variants
pouvant induire une pathologie hépatique. Récem-
ment, la présence d’ARN VHC dans les LMS, en
l’absence d’ARN viral plasmatique a été rapportée
chez des patients avec une réponse virologique prolon-
gée obtenue après thérapie [5]. Chez ces patients en
rémission prolongée, l’infection ne semble pas récidi-
ver à partir d’un site de réplication extra-hépatique.
Dans l’expérience du service d’Hépatologie de l’hôpi-
tal Beaujon et portant sur de nombreux sujets ayant une
réponse virologique prolongée ancienne, la préva-
lence de cette infection extra-hépatique dite résiduelle
est extrêmement basse. Enfin, lors de la transplantation
hépatique, ce sont les souches plasmatiques qui sont
responsables de la réinfection du greffon. Les patients
en rémission thérapeutique avant transplantation ne
semblent pas récidiver. Ceci renforce l’hypothèse que
les souches lymphotropes sont probablement peu
adaptées aux hépatocytes et que leur réplication est
probablement négligeable en cas de réponse virologi-
que prolongée induite par le traitement.
Une autre observation récente rapporte que les
patients présentant une infection des lymphocytes par
les génotypes 2 ou 3 (sensibles à l’interféron) ont une
bonne réponse au traitement indépendamment de la
présence du génotype 1 (peu sensible à l’interféron)
dans le plasma, de la sévérité de la fibrose hépatique
ou de la durée de l’infection [11]. Un statut immunitaire
particulier contre le VHC, particulier aux sujets ayant
ce type de coinfection pourrait favoriser une réponse
virologique. Une autre hypothèse est celle d’une action
directe du VHC au sein des tissus immunitaires favori-
sant la persistance virale. L’inhibition de la réplication
Plasma
#
4
LMS
CD4
CD19
CD14
CD8
Figure 2.Analyse par single strand conformational polymorphism
(SSCP) du site interne d’entrée du ribosome (IRES) du VHC isolé dans
différents compartiments : lymphocytes et monocytes sanguins non
triés, lymphocytes CD4 et CD8 et les monocytes (CD14). La région
encadrée est celle des simples brins. Le profil observé dans les LMS
est la sommation des profils observés dans les sous-types cellulaires.
Mini-revue
Hépato-Gastro, vol. 13, n° 5, septembre-octobre 2006
350
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

virale induite par le traitement dans ces cellules pour-
rait lever l’action putative du VHC sur elles et favoriser
la réponse thérapeutique. Rappelons que dans le cas
des LNH cités plus haut [4], la réponse tumorale était
corrélée à la réponse virologique. Ces deux observa-
tions cliniques pointent vers un rôle direct de l’infection
VHC sur la fonction des cellules immunes.
Conclusion
L’infection des cellules immunes par des variants spéci-
fiques du VHC est à présent une certitude. Les souches
qui y sont présentes sont probablement impliquées
dans le phénomène de persistance virale ou de
lympho-carcinogenèse mais ne semblent pas l’être
significativement dans des phénomènes de récidive de
l’infection après traitement par interféron-alpha ou
transplantation hépatique. Quels que soient les méca-
nismes et conséquences de l’infection extra-hépatique,
celle-ci permet de mettre à jour une population de sujets
coinfectés par des souches distinctes et spécifiques,
absentes du plasma ou du sérum. Cette population
majoritairement contaminée par toxicomanie est pro-
bablement importante et mérite des études complémen-
taires.
En résumé
•La compartimentation réplicative d’un virus est l’existence de
variants différents suivant les types cellulaires infectés par un
virus.
•Elle reflète l’adaptation de ce virus à différents types cellulaires
que cela soit au niveau du (des) récepteur(s) membranaire(s), des
molécules intracellulaires intervenant dans son cycle (décapsida-
tion, traduction, réplication, assemblage, sortie) ou de la réponse
immune dirigée contre les cellules infectées.
•Ce phénomène pourrait avoir un rôle majeur dans la persis-
tance d’une infection virale.
Récepteurs
Réponse immune
miRNA Protéines virales
3
ITAF
IRE
CEE N N N N N NS
5
Figure 3.Mécanismes potentiels de l’adaptation du VHC à un type cellulaire : par la sélection de récepteurs spécifiques, par l’action de
protéines virales (ITAF) ou de microRNA spécifiques sur l’IRES virale, par l’interaction entre protéines cellulaires et virales et par la sélection
immune des variants.
Hépato-Gastro, vol. 13, n° 5, septembre-octobre 2006 351
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
1
/
6
100%