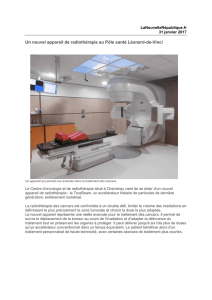
disponible en téléchargement ici

PERJETA 420 mg solution à diluer pour perfusion. WCe médicament fait l’objet d’une surveillance supplémentaire qui
permettra l’identication rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout
eet indésirable suspecté. Voir rubrique Eets indésirables pour les modalités de déclaration des eets indésirables.
COMPOSITION* : Un acon de solution à diluer de 14 ml contient 420 mg de pertuzumab, à une concentration de 30 mg/ml.
Après dilution, un ml de solution contient environ 3,36 mg de pertuzumab pour la dose initiale et environ 1,68 mg de
pertuzumab pour la dose d’entretien. INDICATIONS : Perjeta est indiqué en association au trastuzumab et au docétaxel, dans
le traitement de patients adultes atteints d’un cancer du sein métastatique ou localement récidivant non résécable HER2
positif, n’ayant pas reçu au préalable de traitement anti-HER2 ou de chimiothérapie pour leur maladie métastatique.
POSOLOGIE ET MODE D’ADMINISTRATION* : Soumis à prescription médicale restreinte. Uniquement initié sous la
surveillance d’un médecin expérimenté dans l’administration d’anticancéreux. Administré par un professionnel de santé prêt
à prendre en charge des réactions anaphylactiques et dans un environnement où un équipement complet de réanimation
est immédiatement disponible. Les patients traités avec Perjeta doivent présenter un statut tumoral HER2 positif, déni par
un score 3+ par immunohistochimie (IHC) et/ou un ratio ≥ 2,0 par hybridation in situ (HIS), déterminé par une méthode
validée. An d’assurer des résultats précis et reproductibles, le test HER2 doit être réalisé dans un laboratoire spécialisé, qui
peut garantir la validation des méthodes de test. Posologie : Dose de charge initiale recommandée : 840 mg en perfusion
intraveineuse de 60 minutes, suivie toutes les trois semaines d’une dose d’entretien : 420 mg administrée sur une période de
30 à 60 minutes. Administration des médicaments de façon séquentielle. Administration de Perjeta et trastuzumab dans
n’importe quel ordre. Période d’observation de 30 à 60 minutes recommandée après chaque perfusion de Perjeta et avant le
début des perfusions suivantes de trastuzumab ou de docétaxel. Traitement avec Perjeta jusqu’à progression de la maladie
ou survenue d’une toxicité inacceptable. Oubli ou retard de dose. Modication de dose : Diminutions de dose non
recommandées pour Perjeta. Les patients peuvent poursuivre le traitement au cours des périodes de myélosuppression
réversible induite par la chimiothérapie. Surveillance étroite durant ces périodes pour identier des complications de
neutropénie. Si le traitement avec le trastuzumab est arrêté, le traitement avec Perjeta doit être interrompu. Si le traitement
avec le docétaxel est arrêté, le traitement avec Perjeta et le trastuzumab peut être poursuivi jusqu’à progression de la maladie
ou survenue d’une toxicité inacceptable. Dysfonction ventriculaire gauche : Interruption de l’administration de Perjeta et du
trastuzumab pendant au moins 3 semaines en cas de survenue de l’un des événements suivants : - signes cliniques et
symptômes suggérant une insusance cardiaque congestive (interruption du traitement par Perjeta si une insusance
cardiaque symptomatique est conrmée), - diminution de la fraction d’éjection ventriculaire gauche (FEVG) à une valeur
inférieure à 40 %, - FEVG de 40 % - 45 % associée à une diminution ≥ 10 % par rapport à la valeur initiale. Réactions liées à la
perfusion : Diminution de la vitesse de perfusion ou interruption de la perfusion si le patient développe une réaction liée à la
perfusion. La perfusion peut être reprise après disparition des symptômes. Traitement pouvant également contribuer à
réduire les symptômes : oxygène, bêta-mimétiques, antihistaminiques, solutés par voie I.V. directe et antipyrétiques.
Interruption immédiate de la perfusion si le patient présente une réaction de grade 4 selon la classication NCI-CTCAE
(réaction anaphylactique), un bronchospasme ou un syndrome de détresse respiratoire aiguë. Patients âgés. Patients avec
insusance rénale. Patients avec insusance hépatique. Population pédiatrique. Mode d’administration : Perfusion
intraveineuse. Pas d’administration en injection rapide ou bolus intraveineux. Pour la dose initiale, durée de perfusion
recommandée : 60 minutes. Si la première perfusion est bien tolérée, durée des perfusions suivantes : 30 minutes à
60 minutes. CONTRE-INDICATIONS : Hypersensibilité au pertuzumab ou à l’un des excipients mentionnés à Composition.
MISES EN GARDE SPECIALES ET PRECAUTIONS D’EMPLOI* : Traçabilité des médicaments biologiques. Dysfonction
ventriculaire gauche (incluant l’insusance cardiaque congestive). Réactions liées à la perfusion, réactions
d’hypersensibilité/anaphylactiques. Neutropénies fébriles. INTERACTIONS*. FECONDITE, GROSSESSE ET
ALLAITEMENT*: Contraception ecace pour les femmes en âge de procréer pendant le traitement et 6 mois après la
dernière dose de Perjeta. Non recommandé pendant la grossesse et chez la femme en âge de procréer n’utilisant pas de
contraception. Interrompre l’allaitement, ou interrompre le traitement, en prenant en compte le bénéce de l’allaitement
pour l’enfant au regard du bénéce du traitement avec Perjeta pour la femme. Fécondité. EFFETS SUR L’APTITUDE A
CONDUIRE DES VEHICULES ET A UTILISER DES MACHINES*. EFFETS INDESIRABLES : Résumé du prol de tolérance :
Réactions indésirables les plus fréquentes (> 50 %) : diarrhée, alopécie, neutropénie. Réactions indésirables de grade 3 - 4
selon la classication NCI-CTCAE (version 3) les plus fréquentes (> 10 %) : neutropénie, neutropénie fébrile, leucopénie.
Evénements indésirables graves les plus fréquents : neutropénie fébrile, neutropénie et diarrhée. Décès associés au
traitement chez 1,2 % des patients dans le groupe traité avec Perjeta et 1,5 % des patients dans le groupe sous placebo,
principalement dus à une neutropénie fébrile et/ou une infection. Tableau des réactions indésirables. Réactions
indésirables rapportées chez les patients recevant Perjeta et le trastuzumab après l’arrêt du docétaxel. Description de
réactions indésirables spéciques : Réactions liées à la perfusion, réactions d’hypersensibilité / anaphylactiques.
Neutropénie fébrile. Diarrhée. Rash. Anomalies biologiques. Déclaration des eets indésirables suspectés après l’AMM
importante : Elle permet une surveillance continue du rapport bénéce/risque du médicament. Les professionnels de santé
déclarent tout eet indésirable suspecté via le système national de déclaration. Pour la France : Agence nationale de sécurité
du médicament et des produits de santé (Ansm) et réseau des Centres Régionaux de Pharmacovigilance. Site internet:
www.ansm.sante.fr. SURDOSAGE*. PROPRIETES PHARMACODYNAMIQUES* : Classe pharmacothérapeutique : Agents
antinéoplasiques, anticorps monoclonaux, code ATC : L01XC13. PROPRIETES PHARMACOCINETIQUES*. DONNEES DE
SECURITE PRECLINIQUE*. INCOMPATIBILITES*. CONSERVATION : Flacon avant ouverture : 2 ans, au réfrigérateur (entre
2°C et 8°C) dans l’emballage extérieur à l’abri de la lumière. Ne pas congeler. Solution diluée : Stabilité physique et chimique
après dilution démontrée pendant 24 heures à 30 °C. Toutefois d’un point de vue microbiologique : utiliser le produit
immédiatement. En cas d’utilisation non immédiate : conditions et durées de conservation après dilution et jusqu’à utilisation
relèvent de la seule responsabilité de l’utilisateur, et ne devraient pas dépasser 24 heures entre 2°C et 8°C, sauf si dilution
eectuée dans des conditions d’asepsie dûment contrôlées et validées. PRECAUTIONS PARTICULIERES D’ELIMINATION
ET MANIPULATION*. CONDITIONS DE DELIVRANCE : Liste I. Médicament réservé à l’usage hospitalier. Prescription
réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie. Médicament nécessitant une
surveillance particulière pendant le traitement. Agréé aux collectivités. Inscrit sur la liste des spécialités prises en charge en sus
des GHS. NUMERO AU REGISTRE COMMUNAUTAIRE DES MEDICAMENTS : Perjeta 420 mg solution à diluer pour
perfusion, 1 acon : CIP 34009 584 633 9 6. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE : Roche Registration
Limited- 6 Falcon Way- Shire Park- Welwyn Garden City- AL7 1TW- Royaume-Uni. REPRESENTANT LOCAL : ROCHE – 30, cours
de l’Ile Seguin – 92650 Boulogne Billancourt Cedex – Tel. 01 47 61 40 00. DATE D’APPROBATION/REVISION : Septembre
2013 – V1213.
* Pour une information complète, consulter le RCP disponible sur le site de l’EMA (http://www.ema.europa.eu/) ou à défaut
sur le site de ROCHE (www.roche.fr).
13/09/60912227/PM/001 - 03504/PERJ/0913 - Etabli le 16/12/2013
Nouveau
Le chier utilisé pour vous communiquer le présent document est déclaré auprès de la CNIL. Roche est responsable de ce
chier qui a pour nalité le suivi de nos relations clients. Vous disposez d’un droit d’accès, de rectication et d’opposition aux
données recueillies à votre sujet auprès du Service Juridique de Roche, tél. du standard 0147614000.
(1) Résumé des Caractéristiques du Produit Perjeta® * Date d’AMM : 4 mars 2013
Perjeta® est indiqué en association au trastuzumab et au docétaxel,
dans le traitement de patients adultes atteints d’un cancer
du sein métastatique ou localement récidivant non résécable
HER2 positif, n’ayant pas reçu au préalable de traitement
anti-HER2 ou de chimiothérapie pour leur maladie métastatique.(1)
Bulletin du Cancer Volume 101, numéro 5 mai 2014, p. 397-520
Volume 101 O Numéro 5 O mai 2014
Numéro thématique
Intergroupe ORL

Cet ouvrage a pour objectif de présenter une synthèse
exhaustive des cibles nucléaires qui semblent aujourd'hui
les plus pertinentes, parce qu'elles ont ouvert un champ
d'investigation prometteur et font déjà l'objet de
développements thérapeutiques.
Un point complet sur les activités nucléaires,
ses altérations et les méthodes envisagées
pour y remédier.
Chaque chapitre dévoile une de ces pistes, en
montrant comment une approche des mécanismes
de l'oncogenèse permet de concevoir et de
développer des agents pharmacologiques actifs
contre le cancer.
Enfin, les approches de thérapie génique étant
très nombreuses, la dernière partie aborde les
pistes thérapeutiques les plus encourageantes.
RÈGLEMENT
Ci-joint mon règlement d‘un montant de
———————— €
Par chèque à l‘ordre de
John Libbey Eurotext
Par carte bancaire
Visa
Eurocard/Mastercard
American Express
Carte N°
Saisissez les 3 derniers chiffres inscrits au dos de votre carte
Date d‘expiration Signature :
N° de TVA (obligatoire pour les institutions) :
M.
Mme
Mlle Nom Prénom
Adresse
CP Ville Pays
Tél. E-mail
Je désire recevoir une facture acquittée pour ma déclaration de frais professionnels
Conformément à la loi « Informatique et libertés » du 6/01/1978, vous disposez d‘un droit d‘accès et de rectification aux données personnelles vous concernant.
Pour l‘exercer, adressez-vous aux Éditions John Libbey - 127, avenue de la République - 92120 Montrouge.
PUB/CIBLES-NUCL/06-13 - APE : 5814Z / SIRET : 328 195 904 00037
JE SOUHAITE RECEVOIR
Les cibles nucléaires
en oncologie
29
Les cibles intracytoplasmiques
29
Frais de port + 6
Total
Coordonné par :
Jacques Robert
et Éric Raymond
Thérapie
ciblée
des
cancers
NOITCELLOC
Un CD-Rom inclus
avec des illustrations
couleurs inédites !
www.jle.com
Juin 2013
978-2-7420-0766-0
110 pages
29
7evolume
de la collection
Thérapie ciblée
des cancers
Les cibles
nucléaires
en oncologie
Sur Internet
www.jle.com
(paiement sécurisé)
Par e-mail
contact@jle.com
Par fax
+33 (0) 1 40 92 09 33
Par courrier
Éditions John Libbey Eurotext
127, avenue de la République
92120 Montrouge - France
Pour tout renseignement
+33 (0) 1 46 73 01 38
Les cibles
nucléaires
en oncologies
Coordonné par
Jacques Robert
et Éric Raymond
7
SOMMAIRE
Les cibles nucléaires : gènes, transcrits et protéines
Les inhibiteurs
de PARP : du laboratoire au lit du patient
Le ciblage de la télomérase et des télomères
Le ciblage des kinases cycline-dépendantes (CDK) et des kinases mitotiques Aurora
et Polo-like
Le ciblage de l'interaction MDM2 - p.53
La méthylation de l'ADN
Le ciblage des histones désacétylases
Les thérapies géniques
Juin 2012
978-2-7420-0741-7
104 pages 29
BON DE COMMANDE à retourner aux Éditions John Libbey Eurotext - 127, avenue de la République - 92120 Montrouge - France
Figures
didactiques
Définitions
en marge
de page
?
<lh_[h(&'*
'*".n('Yc/'/(fW][i
?I8D0/-.#(#-&*&#')/*#*
30€
L’enjeu :
soigner sans s’épuiser
Comment préserver sa propre santé et sa passion du métier
dans un contexte professionnel de plus en plus stressant ?
La compréhension du stress est abordée ici dans toutes ses dimensions, tant
socioprofessionnelles que personnelles.
7Ådgk[b[b[Yj[kh#cZ[Y_dfk_ii[YbWh_Å[hYecc[djY[f^decd[W]_j[d
bk_[jbk_l_j[hZ½[dWhh_l[hWkburn-out"_bjhekl[hWZWdiY[]k_Z[fhWj_gk[[j
_bbkijhZ½[n[cfb[i0
Z[if_ij[i[jekj_bibk_f[hc[jjWdjZ½WXekj_h}kd[WffheY^[gk_bk_
Yedl_[dd["ikhb[ifbWdiWdWboj_gk["Ye]d_j_\"cej_edd[b[jYehfeh[b
Z[iYedi[_bifekhfhi[hl[hiedgk_b_Xh[[jkj_b_i[hiedd[h]_[Wk
c_[knfekhied[n[hY_Y["jekj[di[h[iiekhWdj
Z[iW_Z[i}bWhÆ[n_edikhiedfhefh[hWffehjWkijh[ii"Wffb_YWXb[i}
i[ifhefh[ifWj_[dji[dZ_\ÅYkbj
Tension, stress, risque de burn-out….
Toutes les clés pour vous accompagner au quotidien
JekiZ[knfhWj_Y_[di"Isabelle Sauvegrain"Yecc[]dhWb_ij[[jWkii_cZ[Y_dZkjhWlW_b"
[jChristophe Massin"Yecc[fioY^_Wjh["YeddW_ii[djfWh\W_j[c[djb[iYedjhW_dj[i
ifY_Ågk[iZ[b½[n[hY_Y[b_XhWb$
B[khifhefei_j_ediZ[hfedi[iWkijh[iifhel_[dd[djZ[b[kh[nfh_[dY[^kcW_d[[jYb_d_gk["
W_di_gk[Z[b[khickbj_fb[iYedjWYjiWl[YZ[iYed\hh[i"iWdifWhj_fh_iZe]cWj_gk[$
Ouvrage disponible sur www.jle.com
Règlement
Ci-joint mon règlement d‘un montant de
————————
Par chèque à l‘ordre de
John Libbey Eurotext
Par carte bancaire
Visa Eurocard/Mastercard
Carte N°
Saisissez les 3 derniers chiffres inscrits au dos de votre carte
Date d‘expiration Signature :
N° de TVA (obligatoire pour les institutions) :
M. Mme Mlle monérPmoN
Adresse
syaPelliVPC
liam-ETél.
Conformément à la loi « Informatique et libertés » du 6/01/1978, vous disposez d‘un droit d‘accès et de rectification aux données personnelles vous concernant.
Pour l‘exer cer, adressez-vous aux Éditions John Libbey - 127, avenue de la République - 92120 Montrouge.
L’ENJEU-0214 APE : 5814Z / SIRET : 328 195 904 00037
Je souhaite recevoir
L’enjeu :
soigner sans s’épuiser
30
Frais de port +6
Total
Sur Internet
www.jle.com
(paiement sécurisé)
Par e-mail
contact@jle.com
Par fax
+33(0)140920933
Par courrier
Éditions John Libbey Eurotext
127, avenue de la République
92120 Montrouge - France
Pour tout renseignement
+33(0)146730660
à retourner aux Éditions John Libbey Eurotext - 127,avenue de la République - 92120 Montrouge - France
BON DE COMMANDE
Je désire recevoir une facture acquittée pour ma déclaration de frais professionnels

RÉDACTION
Rédacteur en chef
Jacques-Olivier Bay, Clermont-Ferrand
Rédacteurs en chef adjoints
Gilles L’Allemain, Nice
Christophe Massard, Villejuif
Stéphane Vignot, Chartres
Comité de rédaction
Thierry André, Paris
Jean-Yves Blay, Lyon
Jean-Paul Borg, Marseille
Serge Évrard, Bordeaux
Anthony Gonçalves, Marseille
Magali Lacroix, Toulouse
Christian-Jacques Larsen, Poitiers
Nicolas Magné, Saint-Priest-en-Jarez
Jean-Jacques Mazeron, Paris
Philippe Morice, Villejuif
Daniel Orbach, Paris
Pascal Piedbois, Strasbourg
Jacques Robert, Bordeaux
Juliette Thariat, Nice
Marie Wislez, Paris
Formation continue
Jacques Robert, Bordeaux
Maurice Schneider, Nice
Conseil international
Ahmad Awada, Bruxelles
Hamouda Boussen, Tunis
Salem Chouaib, Villejuif
Anne-Marie Mès-Masson, Montréal
René-Olivier Mirimanoff, Lausanne
Guy Storme, Bruxelles
Michel Tremblay, Montréal
Secrétariat
Sylvie Desenclos
Société Française du Cancer
Hôpital Saint-Louis,
1, avenue Claude-Vellefaux,
75475 Paris
Cedex 10, France
Tél. : (33) 1 45 87 27 62
Fax : (33) 1 46 33 20 09
E-mail : bulletin@sfc.asso.fr
Site Internet : www.sfc.asso.fr
Sommaire/Contents
Bull Cancer vol. 101 • N° 5 • mai 2014 397
Éditorial Présentation
STÉPHANE VIGNOT, JULIETTE THARIAT 399
Récapitulatif
Les essentiels du numéro spécial ORL
JULIETTE THARIAT, STÉPHANE VIGNOT 402
Épidémiologie et anatomie des cancers ORL
Epidemiology and anatomy of head and neck cancers
SOPHIE PÉRIÉ, MARIE MEYERS, OLIVIA MAZZASCHI, OLIVIER DE CROUY CHANEL, BERTRAND BAUJAT,
JEAN LACAU ST GUILY 405
Cancers ORL rares et REFCOR, Réseau d’expertise français sur
les cancers ORL rares
Rare tumors of the head and neck; on behalf of the REFCOR, the French Network
of rare head and neck tumors
BERTRAND BAUJAT, JULIETTE THARIAT, ANNE CATHERINE BAGLIN, ANNE CATHERINE COSTES,
SYLVIE TESTELIN, ÉMILE REYT, FRANÇOIS JANOT, ET LES MEMBRES DU REFCOR 412
Cancers de la cavité orale. Mise au point Sous l’égide
de l’Intergroupe ORL
Oral cavity cancer, an update on behalf of Intergroupe ORL
BERTRAND BAUJAT, SOPHIE PÉRIÉ, ÉTIENNE BARDET, JEAN LACAU ST GUILY 424
Cancer de l’oropharynx
Oropharyngeal cancer
DAVID BLANCHARD, JEAN-PIERRE RAME, MARIE-YOLANDE LOUIS, BERNARD GERY,
CARMEN FLORESCU, DOMINIQUE DE RAUCOURT 429
Carcinomes épidermoïdes de l’hypopharynx et du larynx :
prise en charge fondée sur les preuves
Squamous cell carcinoma of the hypopharynx and larynx: evidence-based care
JÉRÔME FAYETTE, YOANN POINTREAU, JEAN BOURHIS, JEAN-LOUIS LEFEBVRE 438
Prise en charge des cancers du cavum (rhinopharynx)
Nasopharyngeal cancers, an overview
PAULINE JARDEL, JULIETTE THARIAT, PIERRE BLANCHARD, FATMA ELLOUMI, NABIL TOUMI,
RENÉ-JEAN BENSADOUN, MOUNIR FRIKHA, JAMEL DAOUD, JEAN BOURHIS 445
Actualités
News
Synthèse
Review
Tumeurs rares
Rare tumours
Synthèses
Reviews

ÉDITEUR
John Libbey Eurotext
127, avenue de la République
92120 Montrouge, France
Tél. : (+33) 01 46 73 06 60
Fax : (+33) 01 40 84 09 99
<dominique[email protected]>
www.jle.com
www.bulletinducancer.fr
Directeur de la publication
Gilles Cahn
Secrétaire de rédaction
Dominique Vatan (01 46 73 06 61)
Secrétariat
Karine Fayolle (01 46 73 01 36)
Département Partenariats et Publicité
– Directrice
Marie-Christine Lasserre (01 46 73 06 76)
– Chef de publicité
David Laifer (01 46 73 97 70)
– Secrétaire
Corinne Salmon (01 46 73 06 63)
Marketing
Bérengère Brun (01 46 73 01 39)
FABRICATION
Prépresse : Thomson Digital (Mauritius)
Ltd, île Maurice
Corlet Imprimeur SA ZI, route de Vire
14110 Condé-sur-Noireau, France
No 127578
Abonnements
AMIX/Service abonnements John Libbey
BP 10320
326, rue du Gros-Moulin
45200 Amilly
Tél : 02 38 90 89 50
Fax : 02 38 98 41 15
Référencement
Revue adhérente au Speps (Syndicat
de la presse et de l’édition des
professions de santé)
Le Bulletin du Cancer est indexé dans :
Biological Abstracts/Biosis, Scopus,
Current Contents®/Life Sciences &
Clinical Medicine, Embase/Excerpta
Medica, Index medicus/Medline,
Medexpress, Science Citation Index, Pascal,
Sociedad Iberoamericana de Informacíon
Científi ca (SIIG) Google Scholar
Revue mensuelle 12 numéros par an
France : 373 € TTC
Voir tarifs complets sur la page
d’abonnement insérée dans ce numéro
ISSN (Bull Cancer) : 0007-4551
ISSN (Bull Cancer en ligne) : 1769-6917
Commission paritaire : 1114 T 81215
Dépôt légal : à parution
Instructions aux auteurs : 2e de couv.
Bulletin d’abonnement : page 395
Liste des annonceurs : Pages 400-401, ;
4e de couv, Roche.
page 396 et 3e
Sommaire/Contents
Bull Cancer vol. 101 • N° 5 • mai 2014
398
Photo de couverture : quizz
Patiente de 77 ans non fumeuse qui présente une lésion intra-parotidienne droite
profonde hyperfi xante en TEP scanner (SUV 13) et qui correspond en scanner et IRM à
une adénopathie dense de découverte fortuite lors d’un bilan de mélanome choroidien
T2a homolatéral.
Quel est votre diagnostic ?
1. Métastase ganglionnaire du mélanome uvéal
2. Tumeur de Whartin
3. Adénopathie d’un cancer des voies aérodigestives méconnu
4. Adénopathie infl ammatoire non néoplasique
5. Primitif parotidien
Les adénopathies métastatiques d’un carcinome épidermoïde
sans porte d’entrée. Quelle est l’attitude actuelle ?
Lymph node metastases from squamous cell carcinoma of unknown
primary site. Is it time to change of paradigm?
MARC HAMOIR, IDRISS TROUSSIER, JEAN-PASCAL MACHIELS, HERVÉ REYCHLER,
SANDRA SCHMITZ, JULIETTE THARIAT, VINCENT GRÉGOIRE 455
Critères de qualité en anatomopathologie et nouveaux outils
théranostiques en cancérologie tête et cou
Quality control in pathology and theranostics in head and neck cancers
CLAIRE FAURE, CÉCILE BADOUAL, BERTRAND FLEURY, GÉRARD MILANO, JULIETTE THARIAT 461
Imagerie des cancers ORL
Imaging in head and neck cancers
ANTOINE IANNESSI, MATTHIEU JOHN OUVRIER, JULIETTE THARIAT, PIERRE-YVES MARCY 469
Critères de qualité en radiothérapie des cancers de la tête
et du cou sous l’égide de l’Intergroupe ORL
Quality criteria in radiotherapy for head and neck cancers under
the aegis of Head and Neck Intergroup
YUNGAN TAO, NADEJEDA VINTONENKO, ROBIN GARCIA, VINCENT MARCHESI,
MILAN TOMSEJ, ETIENNE BARDET, JEAN BOURHIS 481
Critères de qualité en oncologie médicale pour la prise
en charge des cancers de la tête et du cou
Quality assurance in head and neck medical oncology
LAURENCE DIGUE, STÉPHANE PEDEBOSCQ 486
Critères de qualité en chirurgie carcinologique cervicofaciale
Quality assurance in head and neck surgical oncology
SÉBASTIEN VERGEZ, FRANCK JEGOUX, GILLES DOLIVET, SYLVAIN MORINIÈRE 496
Qualité de vie des patients et soins de support
en cancérologie des VADS
Quality of life and supportive care in head and neck cancers
EMMANUEL BABIN, NATACHA HEUTTE, GUILLAUME GRANDAZZI,
VIRGINIE PRÉVOST, LAETITIA ROBARD 505
Les récidives des tumeurs des voies aérodigestives supérieures
Recurrence of upper aerodigestive tract tumors
LAURENT MARTIN, MUSTAPHA ZOUBIR, CHRISTOPHE LE TOURNEAU 511

doi : 10.1684/bdc.2014.1961
Bull Cancer vol. 101 •N◦5•mai 2014
Éditorial
©John Libbey Eurotext
Stéphane Vignot,
Juliette Thariat
Étienne Bardet (GORTEC
et coordinateur de
l’intergroupe), Juliette
Thariat (GORTEC),
Dominique De Raucourt
(GETTEC), Franck Jegoux
(GETTEC), Franc¸ois Janot
(GETTEC), Jean Lacau
(GERCOR), Dominique
Notelet (GERCOR), Benoist
Chibaudel (GERCOR),
Nadejda Vintonenko
(manager Intergroupe),
Jean Bourhis (GORTEC)
Présentation
Pour citer cet article : Vignot S, Thariat J. Présentation. Bull Cancer 2014 ; 101 : 399.
doi : 10.1684/bdc.2014.1961.
LeBulletin du Cancer a sollicité la réali-
sation d’un numéro thématique ORL en
2014, pour témoigner des évolutions de ces
cancers sur le plan épidémiologique, du glis-
sement des standards vers des approches moins
invasives et plus personnalisées et pour rappeler
le rôle fondamental et quotidien de la multidisci-
plinarité, bien mise en exergue par l’Intergroupe
ORL (fusion labellisée par l’INCa de trois groupes :
GORTEC pour l’oncologie radiothérapie, GETTEC
pour la chirurgie et GERCOR pour l’oncologie
médicale) qui a pris en charge ce numéro.
Cette collaboration s’exprime par les discussions
incluant tous les acteurs médicaux des réunions
de concertation pluridisciplinaire (RCP) : radio-
logue, pathologiste, chirurgien, radiothérapeute,
oncologue médical, mais aussi les professionnels
paramédicaux, infirmières, diététiciens, assistantes
sociales, dont l’aide est particulièrement indispen-
sable dans la prise en charge des patients atteints
de cancers des voies aérodigestives supérieures.
Ce numéro thématique du Bulletin du Cancer
illustre le dynamisme de cette discipline au tra-
vers d’articles de synthèse précis et actualisés, dont
les points clefs sont présentés en exergue de cet
éditorial.
L’intergroupe ORL
(GORTEC-GETTEC-GERCOR)
L’Intergroupe ORL regroupe le GORTEC (Groupe
d’oncologie radiothérapie tête et cou), le GETTEC
(Groupe d’étude des tumeurs de la tête et du cou) et
le GERCOR (Groupe coopérateur multidisciplinaire
en oncologie)
L’Institut national du cancer a pour mission de
coordonner et d’animer la recherche clinique et
translationnelle en cancérologie académique. En
France, les acteurs de la recherche clinique acadé-
mique en cancérologie sont notamment organisés
en de multiples sociétés savantes et groupes coopé-
rateurs. Pour permettre une meilleure efficacité dans
les actions et réduire le nombre d’interlocuteurs
représentatifs, l’INCa a décidé de soutenir leur
regroupement et leur structuration à travers un appel
à candidatures. Publié en mars 2012, cet appel
à candidatures s’adressait à des structures opéra-
tionnelles de la recherche clinique académique en
cancérologie, indépendantes et à but non lucratif,
associant des médecins et des professionnels de la
recherche médicale.
Évalués par un comité d’experts internationaux,
six intergroupes coopérateurs dont l’Intergroupe
ORL ont été labélisés par l’INCa en 2012 sur
la base de leur envergure, leur visibilité inter-
nationale, leur capacité à réaliser la recherche
clinique et cognitive, à collaborer dans le domaine
de la recherche clinique, à gérer les essais cli-
niques et les ressources humaines dévolues à la
recherche. Cette labellisation permet de consoli-
der les collaborations déjà existantes entre nos
différents groupes et de renforcer le poids de la
recherche franc¸aise dans le domaine du cancer des
VADS.
Reconnaissance par un organisme d’état de notre
démarche fédérative, de notre impact national et
international dans le domaine de la recherche
clinique pour les tumeurs de la tête et du
cou, cette labellisation sera publiée au Journal
officiel. Le renouvellement du label fera l’objet
d’un rapport d’activité et d’un rapport financier
annuel.
399
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
1
/
127
100%