TS Transformation en chimie organique P3 (comp)

TS Transformation en chimie organique P3 (comp) - S2
Objectifs •
•
•
• !
•"#
Introduction
L’écorce de saule est connue depuis l’Antiquité pour ses propriétés antalgique et antipyrétique.
La salicyline, responsable de ces propriétés, présentait l’inconvénient d’être très agressive pour l’estomac.
Vers la fin des années 1890, un chimiste allemand, Felix Hoffmann, lui fit subir plusieurs transformations
chimiques de manière à modifier ses groupes caractéristiques. Il synthétisa ainsi une molécule nettement
mieux tolérée par l’estomac : l’acide acétylsalicylique (nom commercial : Aspirine).
A l'instar de cet exemple, quels sont les mécanismes des grands types de réactions en chimie organique ?
1. Modification d'une molécule organique
1.1. Modification de la chaîne carbonée
Les molécules d'hydrocarbures issus de la distillation du pétrole servent de matière première à l'industrie
chimique. La modification de leur chaîne carbonée (apparition ou disparition d’une liaison simple,
double ou triple) s'avère nécessaire car ils ne correspondent pas toujours aux besoins de la pétrochimie :
•essences pour l’automobile (amélioration de l’indice d’octane) ;
•production d'intermédiaires de synthèse importants (fabrication de pesticides, parfums,
médicaments...)
•production de matières plastiques.
Plusieurs techniques sont utilisées, selon l'objectif souhaité :
➜$
Chauffer des molécules à longue chaîne permet de les casser afin de les réduire en molécules à chaîne
courte. La nature des produits dépend de différents facteurs dont la température (de 300 °C à 850 °C).
L'intérêt majeur du craquage thermique est néanmoins de produire des alcènes, principalement l’éthène et le
propène, qui sont à la base de nombreuses synthèses organiques (matières plastiques entre autres).
➜$
Le chauffage entre 120 °C et 200 °C permet de transformer une chaîne linéaire en chaîne ramifiée.
Par exemple l’hexane peut ainsi donner du 2,2-diméthylbutane :
➜%
Le chauffage entre 120 °C et 200 °C peut aussi permettre la cyclisation d’hydrocarbures si l’alcane possède
au moins cinq atomes de carbone..
Sébastien Picandet TS - P3 (Comp) S2 - Page 1/5 21/01/2014
&'()(

➜"*
Une addition répétée d’un très grand nombre de molécules insaturées appelées monomères
conduit à une macromolécule appelée polymère.
Ces réactions permettent la fabrication des matières plastiques :
ou
n est appelé indice de polymérisation et le groupe est appelé motif du polymère.
- A - H - H3C - Cl - H5C6
Monomère
Nom du polymère polyéthylène (PE) polypropylène (PP) polychlorure de
vinyle (PVC)
Polystyrène (PS)
1.2. Modification du groupe fonctionnel
Recréer des molécules existant à l’état naturel ou synthétiser un nouveau composé passe nécessairement par
la création, la modification ou la suppression d’un groupe caractéristique au sein de l’espèce chimique
initiale.
➜+
Lors d'une oxydation ménagée, la chaîne carbonée de la molécule d’alcool n’est pas modifiée, seul le
groupe caractéristique change. Selon la classe de l'alcool, on obtient un aldéhyde ou une cétone.
➜&
Il est possible de modifier simultanément la chaîne carbonée et le groupe caractéristique d’une molécule.
C’est le cas dans cet exemple d'ozonolyse d’un alcène (action de l’ozone suivie d’une réaction d’hydrolyse)
qui conduit à une rupture de chaîne et à la création d'un groupement carbonyle.
Sébastien Picandet TS - P3 (Comp) S2 - Page 2/5 21/01/2014
&((),
&-./0()11()1&-./''())'2())

2. Grandes catégories de réactions en chimie organique
2.1. Les réactions de substitution
$ : CH3 - OH + H - Cl → CH3 - Cl + H2O
Ici, un alcool (le méthanol) est transformé en halogénoalcane (le chlorométhane). C'est une réaction de
substitution car un atome de chlore remplace un groupe OH sur la chaîne carbonée de la molécule
organique.
Une réaction de substitution consiste à remplacer, sur une molécule organique, un atome ou un
groupe d’atomes (en général, le groupe caractéristique), par un autre issu d'un réactif, qui est
l’agent de la transformation.
2.2. Les réactions d'addition
$ : H2C = CH2 + H2O → H3C - CH2 – OH
Dans l’hydratation de l’éthène en éthanol, une des deux liaisons carbone-carbone de l’éthène se rompt au
profit d’une liaison simple entre H, d’une part, et OH, d’autre part.
Une réaction d'addition consiste à créer deux liaisons simples à partir d'une liaison double, sur
une molécule organique insaturée de manière à lui ajouter, un atome ou un groupe d’atomes,
issu d'un réactif, qui est l’agent de la transformation.
2.3. Les réactions d'élimination
$ : H3C - CH2 - OH = H2C = CH2 + H2O
Dans la réaction de déshydratation de l’éthanol en éthène, une molécule d’éthanol perd une molécule d’eau.
Une réaction d'élimination consiste à créer une liaison double par disparition de deux liaisons
simples sur une molécule organique saturée en éliminant un atome ou un groupe d’atomes.
3. Liaison chimique polarisée
3.1. L'électronégativité et liaison covalente
L’électronégativité χ caractérise l'aptitude d’un élément chimique à attirer à lui le doublet liant d'électrons
partagé dans une liaison chimique avec un autre élément.
Globalement, l'électronégativité augmente de bas en haut et de gauche à droite dans la classification
périodique.
Pour les principaux éléments rencontrés en chimie organique, cela donne par ordre croissant :
3 4 5 6 7 % 6 8
9" 1,3 2,2 2,5 3,0 3,0 3,2 3,4
La nature de la liaison chimique A – B dépend de la différence d’électronégativité entre A et B :
:9;9%<9&=>:9>=2 =2>:9>'1 '1>:9>,,
7&<% Covalente apolaire Covalente polaire Ionique
/ C – H , C – C C – O , C – N , O – H Mg – Cl , Mg – Br
Dans une liaison polaire, le nuage électronique n’est pas symétrique car l'attraction du doublet
liant vers les noyaux des deux atomes est inégale.
Sébastien Picandet TS - P3 (Comp) S2 - Page 3/5 21/01/2014
&,()2
&-./(,'?
&-./'?,==(2,=(
&',=1

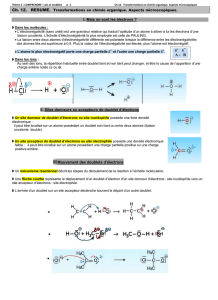
3.2. Sites donneurs ou sites accepteurs de doublets d'électrons
Identifier les sites donneurs et les sites accepteurs de doublet d’électrons, c'est repérer la répartition des
charges électriques élémentaires partielles dans une liaison chimique polaire :
•l’atome le plus électronégatif porte la charge partielle négative δ-,
•l'atome le moins électronégatif porte la charge partielle positive δ+.
Un site donneur (respectivement accepteur) de doublet d’électrons est un atome porteur d’un
excédent de charges électriques négatives, partielle δ- ou totale (respectivement positives,
partielle δ+ ou totale).
$ En chimie organique :
•Les sites donneurs portent souvent un doublet non-liant d'électrons.
Exemples : –OH , –NH2 , anion
•Les sites accepteurs sont souvents des atomes de carbone électropositif
Exemples : –C=O , cation
3.3. Interactions entre sites donneurs et sites acceptateurs
Une transformation chimique subie par un système chimique est modélisée par une réaction chimique :
•A l’échelle macroscopique, l'équation de la réaction fait le bilan (en moles d’espèces chimiques) des
réactifs disparus et des produits formés.
% : CH3 - OH + H - Cl → CH3 - Cl + H2O
•A l’échelle microscopique (atomique ou moléculaire), le mécanisme de la réaction permet de
connaître la manière dont les réactifs ont réagi pour donner les produits.
Afin d'écrire le mécanisme d’une réaction, on utilise des flèches courbes qui permettent d’expliquer la
formation ou la rupture de liaisons.
4 :
(1)
(2)
(3)
Dans un mécanisme réactionnel, les flèches courbes représentent le sens réel de déplacement
d’un doublet du site donneur vers le site accepteur.
Sébastien Picandet TS - P3 (Comp) S2 - Page 4/5 21/01/2014
&(,'=
+*#-./(@,=((',(=((,('
&-./'?,'1
&-./@,'@

TS Transformation en chimie organique P3 (comp) - S2
Avant le début du cours : vidéoprojecteur et caméra connecté à l'ordinateur du bureau dans l'amphithéâtre
1. Grandes catégories de réactions en chimie organique
Vidéo manuel numérique page 294
Sébastien Picandet TS - P3 (Comp) S2 - Page 5/5 21/01/2014
1
/
5
100%