MECANISMES REACTIONNELS EN CHIMIE ORGANIQUE

Introduction aux mécanismes réactionnels
MECANISMES REACTIONNELS
EN CHIMIE ORGANIQUE
Transformation chimique en chimie organique.
1. MECANISME REACTIONNEL.
Une transformation chimique ne consiste pas en une simple transformation de réactifs en produits, comme semble
l’indiquer l’équation de réaction qui la résume, mais résulte d’un processus complexe.
Initié par un choc, un mécanisme réactionnel peut être décomposé en une succession d’étapes appelées réactions
élémentaires.
2. TOUT EST UNE QUESTION D’ELECTRONS.
a. Réaction d’oxydoréduction.
Une réaction d’oxydoréduction consiste en un transfert d’un ou plusieurs électrons d’une espèce chimique réductrice vers
une espèce chimique oxydante.
b. Réaction acidobasique.
Dans le cadre de la théorie de Brönsted, une réaction acidobasique consiste en un transfert de protons, H+, d’une espèce
chimique vers une espèce chimique basique.
Cependant, cette théorie est restrictive, et ne permet pas d’expliquer les propriétés acides d’espèces chimiques comme le
chlorure d’aluminium, par exemple.
Dans le cadre de la théorie de Lewis, plus générale, une réaction acidobasique ne consiste plus en un transfert de protons,
mais de doublets d’électrons. Un acide est alors susceptible de capter un doublet d’électrons, et une base susceptible d’en
céder.
Ex : AlCl3 Al (Z = 13) : (K)2(L)8(M)3
L’atome d’aluminium possède une lacune électronique. Il est donc susceptible de capter un doublet d’électrons.
Par conséquent, c’est donc un acide de Lewis
Rq : La théorie de Lewis englobe la théorie de Brönsted. Tout acide de Brönsted est un acide de Lewis, et toute base de
Brönsted est une base de Lewis.
NH3 N (Z = 7) : (K)2(L)5
L’atome d’azote possède un doublet non-liant. C’est une base de Lewis.
3. ELECTROPHILE VS. NUCLEOPHILE.
a. Notion d’électronégativité.
L’électronégativité d’un atome traduit sa tendance à attirer un
doublet liant vers lui.
Le carbone sert de référence en chimie organique. Si un élément a
une électronégativité plus élevée que le carbone, il est considéré
comme électronégatif. S’il a une électronégativité plus faible que le
carbone, il est considéré comme électropositif.
b. Polarité d’une liaison.
Lorsqu’il existe une différence d’électronégativité entre deux
éléments A et B liés par un doublet liant, le nuage électronique
formant la liaison n’est plus symétrique. Il se forme alors un dipôle :
, avec < 1.
Chacun des deux atomes porte alors une charge électrique partielle , et la liaison est dite polarisée.
c. Notion d’induction.
La polarisation d’une liaison a une influence sur son environnement.
Soit la chaîne , avec .
La polarisation de la liaison induit un effet de polarisation sur la liaison voisine , qui se polarise à son tour,
toutefois plus faiblement.
d. Donneur ou accepteur.
Au sein d’une espèce chimique, un atome pourra être caractérisé en fonction de la réponse qu’il apporte à la question
suivante : Est-il susceptible de capter ou de céder des électrons ?
Un atome portant une charge (même partielle) positive a tendance à vouloir capter des électrons. Il est dit électrophile.
Un atome portant une charge (même partielle) négative a tendance à vouloir céder des électrons. Il est dit nucléophile.
x
x
x
xx
x
x
x

Introduction aux mécanismes réactionnels
Rq : Un atome possédant des doublets non-liants est généralement nucléophile.
Une réaction élémentaire consiste généralement en l’interaction entre un site nucléophile et un site électrophile.
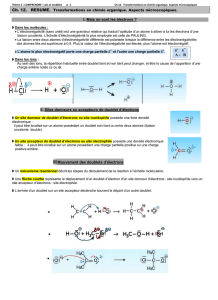
e. Mécanisme de l’estérification.
La réaction d’estérification est une réaction entre un acide carboxylique et un alcool.
Pour initier le mécanisme, on peut remarquer que l’atome de carbone du groupement carboxyle est électrophile, alors que
l’oxygène de la fonction alcool est nucléophile.
Chaque flèche représente le mouvement d’un doublet d’électrons, toujours orienté vers un atome. Cela peut être un
doublet non liant qui se transforme en doublet liant, ou un doublet liant qui devient un doublet non liant.
1ère étape :
C
OH
O
R1+OH R2R1C
O+
O-
OH
R2H
2ème étape :
R1C
O+
O-
OH
R2H
C
O-
O+
R1
O
R2
H
H
3ème étape :
C
O-
O+
R1
O
R2
H
HR1CO
O
R2
+OH2
Quelques mécanismes en chimie organique.
1. SUBSTITUTION.
Une substitution consiste à modifier une molécule organique en remplaçant un groupement d’atomes de la molécule par
un autre.
Une substitution est souvent nucléophile, c’est-à-dire que le substituant est nucléophile.
Rq : « Y- » n’est qu’une notation indiquant le caractère « nucléophile » du substituant. Ça peut être un ion, mais aussi
une molécule non chargée possédant au moins un doublet non-liant.
2. ELIMINATION.
Une élimination consiste à modifier une molécule organique en lui retirant un groupe d’atomes.
C CR1
OH H
R3
R4
R2
C C
R1R3
R4
R2+OH2
3. ADDITION.
Une addition consiste à modifier une molécule organique en lui ajoutant un groupe d’atomes. Elle se fait principalement
sur les liaisons éthyléniques (C=C).
C CR1
OH H
R3
R4
R2
C C
R1R3
R4
R2+OH2
Sélectivité en chimie organique.
1. REACTION CHIMIQUE ET STATISTIQUES.
Une réaction chimique est issue de chocs aléatoires entre entités chimiques. L’équation de réaction ne traduit que le
résultat issu des chocs les plus probables statistiquement.
Dans de nombreux cas, une seule équation de réaction ne suffit pas à traduire ce qui peut se passer lorsqu’on met en
contact deux réactifs. Il peut exister plusieurs chemins réactionnels de probabilité proche.
A + B = C ; A + B = D ; A + B = E ; …
Il est alors nécessaire de pouvoir prendre le contrôle de l’évolution du système afin d’obtenir le produit souhaité.

Introduction aux mécanismes réactionnels
2. CONTROLE CINETIQUE VS. CONTROLE THERMODYNAMIQUE.
Un système est dit sous contrôle cinétique lorsqu’on favorise l’état final le plus « facile » à obtenir, c’est-à-dire celui dans
lequel l’énergie pour qu’un choc soit efficace est la plus faible. Pour cela, il suffit de limiter les apports en énergie,
notamment en travaillant à basse température.
Un système est dit sous contrôle thermodynamique lorsqu’on favorise l’état final le plus stable, c’est-à-dire celui dans
lequel les produits formés sont les plus stables. Pour cela, il suffit d’apporter beaucoup d’énergie au système, afin de
s’assurer que le plus de chocs possibles puissent être efficaces. Le système va alors spontanément évoluer vers l’état le plus
stable. Pour cela, on travaille à haute température.
Ex : A basse température, l’addition du bromure d’hydrogène sur du buta-1,3-diène donne du 3-
bromobut-1-ène.
CH2CH
CH CH2+BrH
CH2CH
CH CH3
Br
A température élevée, l’addition du bromure d’hydrogène sur du buta-1,3-diène donne du 1-
bromobut-2-ène.
CH2CH
CH CH2+BrHCH2
CH CH
CH3
Br
3. ROLE DU CATALYSEUR.
Un catalyseur facilite une réaction en modifiant le mécanisme réactionnel qu’elle met en jeu. Un choix judicieux de
catalyseur permet alors de modifier les statistiques et favoriser un chemin réactionnel par rapport aux autres.
Ex : En présence de cuivre, le chauffage de l’éthanol donne de l’éthanal.
En présence d’alumine, le chauffage de l’éthanol donne de l’éthène.
4. PRINCIPE DE PROTECTION.
Une espèce chimique peut posséder plusieurs sites nucléophiles ou électrophiles potentiels. Il peut alors être possible de
bloquer certains de ces sites à l’aide de réactions chimiques préliminaires et spécifiques, empêchant ainsi toute action de
leur part.
Un groupement hydroxyle, nucléophile, peut par exemple être oxydé en groupement carbonyle, qui a un comportement
électrophile. Cela élimine ainsi un site nucléophile d’une molécule. Après avoir réalisé la réaction souhaitée, une réduction
du groupement carbonyle permet de retrouver le groupement hydroxyle initial.
Stratégies de synthèse organique.
Tout ce qui précède permet de synthétiser des molécules organiques à l’infini. Ainsi, il existe plusieurs dizaines de millions
de molécules répertoriées dans les laboratoires du monde entier.
La plupart de ces molécules peuvent être obtenues par de multiples chemins réactionnels. Avant toute synthèse, il est donc
nécessaire d’établir une stratégie prenant en compte les différentes chemins réactionnels et les différents paramètres mis
en jeu.
La connaissance notamment des conditions expérimentales (température, pression, …) et de la nocivité des espèces
chimiques employées et obtenues doit toujours amener à choisir le chemin le moins « risqué » pour l’individu et pour
l’environnement (notamment concernant les déchets produits). On parle alors de chimie verte.
Un des critères objectifs pour effectuer le choix de la « meilleure » stratégie est l’utilisation atomique, UA. Il s’agit d’un
indicateur d’efficacité d’un procédé, qui permet de déterminer la proportion de sous-produits, et donc de déchets,
obtenus.
Plus l’utilisation atomique d’un procédé est proche de 1, moins il y a de sous-produits, et donc plus le procédé est
« propre ».
Rq : Dans la littérature, on utilise parfois le terme d’économie d’atomes (EA) pour désigner ce critère.
Ex : L’ibuprofène, substance active de nombreux médicaments anti-inflammatoires peut être obtenu par deux
procédés. Mis au point en 1960, le procédé Boots avait une UA = 0,40. Depuis les années 1990, on privilégie le
procédé BHC qui a une UA = 0,77.
1
/
3
100%