Nouveaux marqueurs du risque de mort subite d`origine rythmique

Revue
Nouveaux marqueurs
du risque de mort subite
d’origine rythmique :
apport de la quantification
du signal électrique
cardiaque
Philippe Chevalier
1
, Paul Rubel
2
, Jocelyne Fayn
2
1
Service de soins intensifs et de rythmologie, hôpital Louis-Pradel, 28, avenue du Doyen-
Lépine, 69394 Lyon
2
Unité Inserm 107, Lyon
Résumé
Nous sommes toujours en quête d’un marqueur spécifique du risque électrique ventriculaire.
Dans ce but, l’analyse des principaux événements de l’activité électrique cardiaque que sont
l’activité sinusale, la dépolarisation et la repolarisation ventriculaires a fait l’objet de nombreux
travaux. Jusqu’à présent, les résultats ayant trait à l’étude de l’activité sinusale sont plutôt
décevants. L’utilisation de nouveaux outils de traitement du signal électrique s’attachant à
quantifier la dépolarisation et la repolarisation ventriculaires semble une approche très
prometteuse. À Lyon, nous développons l’analyse par ondelettes et la technique spatio-
temporelle 3D de l’ECG. Des outils informatiques de reconnaissance de forme sont aussi en
cours d’évaluation dans notre laboratoire. Grâce à ces investigations, l’identification des
patients à risque de mort subite ou de l’efficacité d’un traitement antiarythmique sera quanti-
fiable. Le but de cet article est d’exposer ces nouvelles technologies en s’appuyant sur des
rappels de physiologie.
Mots clés : mort subite, signal électrique, arythmies ventriculaires
Abstract. New sudden cardiac death risk markers: quantification of the ventricu-
lar electrical signal
We are still looking for a specific ventricular electrical risk marker. With this aim, the analysis
of the main cardiac electrical events, which are sinus activity, ventricular depolarization and
repolarization, have been examined in many studies. Up to now, the results of studies looking
at sinus activity are quite disappointing. The use of new tools for treating the electrical signal,
with a view to quantifying ventricular depolarization and repolarization, seems to be a very
promising approach. In Lyon, we are developing wavelet analysis and a spatio-temporal
3-dimensional ECG technique. Computerized shape recognition tools are also being assessed
in our laboratory. Thanks to these investigations, it will be possible to quantify the identification
of patients at risk of sudden death and the efficacy of antiarrhythmic treatment. The aim of this
review is to show off these new technologies, bearing in mind the physiological systems
involved.
Key words: sudden cardiac death, electrical risk marker, ventricular arrhythmias
m
t
c
Tirés à part : P. Chevalier
mt cardio 2005 ; 1 : 229-35
mt cardio, vol. 1, n° 3, mai-juin 2005 229
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Position du problème
Trois points méritent d’être rappelés avant d’aborder la
difficile question de l’identification des patients à risque
d’arythmie ventriculaire maligne :
–Ilyaunmanque de données épidémiologiques de la
mort subite d’origine rythmique en partie lié à sa définition
et à ses causes multiples ;
–la physiopathologie des arythmies ventriculaires est
complexe ; chacun des éléments du triangle de Coumel
[1] et leurs interactions restent à décrypter ;
–l’emploi abusif du défibrillateur automatique im-
plantable (DAI) témoigne des difficultés d’identification
des patients à risque de fibrillation ventriculaire.
Nous sommes toujours à la recherche d’un marqueur
spécifique du risque électrique ventriculaire. Dans ce but,
l’analyse des principaux événements de l’activité électri-
que cardiaque que sont l’activité sinusale, la dépolarisa-
tion ventriculaire et la repolarisation ventriculaire a fait
l’objet de nombreux travaux [2, 3]. Jusqu’à présent, les
résultats ayant trait à l’étude de l’activité sinusale sont
plutôt décevants. L’utilisation de nouveaux outils de trai-
tement du signal électrique s’attachant à quantifier la
dépolarisation et la repolarisation ventriculaires semble
une approche très prometteuse. Le but de cet article est
d’exposer cette nouvelle technologie en s’appuyant sur
des rappels de physiologie.
Nœud sinusal
Le système nerveux autonome module l’activité sinu-
sale. Ce contrôle s’exerce principalement par l’intermé-
diaire du courant If, seul courant entrant activé par l’hy-
perpolarisation et très sensible aux neurotransmetteurs de
nature cholinergique et catécholergique [4]. Bien que l’on
connaisse maintenant son manque de spécificité à prédire
les arythmies ventriculaires, les indices de variabilité sinu-
sale ont été les premiers paramètres étudiés comme mar-
queurs de risque électrique [3]. La variabilité du rythme
sinusal est d’autant plus importante que le sujet est jeune
et en bonne santé [5]. À l’inverse, un rythme trop régulier,
trop stable, traduit un mauvais état de santé aussi bien
cardiaque que général. L’activité du nœud sinusal est
assimilée à un oscillateur, dépendant de l’équilibre entre
les tonus sympathique et vagal, la fameuse « balance
sympathovagale ». Ses variations amples sont nécessaires
pour l’adaptation aux contraintes d’un environnement qui
peut être très changeant tout au long du nycthémère. La
perte de cette souplesse, de cette variation de la cadence
sinusale, est le témoin d’un organe ou d’un organisme
malade, fragile et vulnérable, terrain propice à une aryth-
mie.
Analyse par ondelettes
de la variabilité sinusale
La mesure de la variabilité sinusale est réalisée soit
dans le domaine fréquentiel, soit dans le domaine tempo-
rel [6]. L’utilisation de nouveaux traitements mathémati-
ques d’analyse du signal électrique est supposée quantifier
l’activité sinusale. Nous utilisons à Lyon la méthode des
ondelettes [7]. Cette technique permet une localisation en
temps et en fréquence des variations du signal électrique.
Elle autorise aussi la détection des variations brutales et
brèves du rythme cardiaque, qui échappent à l’analyse
conventionnelle. La règle consiste à transformer un signal
en nombre et coefficient, que l’on peut enregistrer et
analyser, transmettre ou utiliser pour reconstruire le signal
original. Les ondelettes s’adaptent automatiquement aux
différentes composantes du signal et utilisent une fenêtre
étroite, pour décrire les composantes transitoires de haute
fréquence et une fenêtre large, pour suivre les composan-
tes de longue durée de basse fréquence. Cette procédure
s’appelle la multirésolution [6].
Nous avons recherché des éléments prédictifs de fi-
brillation ventriculaire à l’aide de l’analyse des intervalles
RR précédant une arythmie chez des patients avec DAI
[7]. La mémoire de ces appareils permet de disposer des
intervalles RR d’1 h 30. Nous avons pu mettre en évidence
des différences significatives entre les deux populations,
qui survenaient bien avant l’intervention du DAI [7]. Ces
différences se situaient à la fois sur les échelles de haute et
de basse fréquences sur l’ensemble du signal alors que,
juste avant la fibrillation ventriculaire, les différences
étaient présentes principalement dans les échelles de
haute fréquence.
Turbulence de la fréquence cardiaque
Cette méthode quantifie les fluctuations des cycles
sinusaux après les battements ventriculaires prématurés.
Le rythme sinusal qui suit un battement ventriculaire pré-
maturé a normalement un aspect biphasique avec une
accélération précoce et une décélération tardive. Chez les
patients après infarctus du myocarde à haut risque de mort
subite, cette variation, appelée turbulence de la fréquence
cardiaque, est atténuée ou absente [8]. En effet, une sys-
tole ventriculaire influence le nœud sinusal, même en
l’absence de conduction rétrograde ventriculaire.
À l’origine de ce phénomène, une modification du tonus
autonome et une traction mécanique sur les auricules ou
sur le tissu de conduction atrio-ventriculaire ont été évo-
quées. Une méthode de quantification de la turbulence
cardiaque a été développée et validée dans deux popula-
tions de patients avec infarctus du myocarde [9].
Liste des abréviations
DAI : défibrillateur automatique implantable
ECG : électrocardiogramme
Nouveaux marqueurs du risque de mort subite d’origine rythmique
mt cardio, vol. 1, n° 3, mai-juin 2005
230
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Sensibilité du baroréflexe
Les barorécepteurs artériels sont localisés dans le sinus
carotidien et dans l’arche aortique. Ces récepteurs sont
sensibles à la pression artérielle moyenne. Une augmen-
tation de la pression artérielle est à l’origine d’une activa-
tion parasympathique qui diminue la fréquence cardiaque
[10]. Le mécanisme liant la perte de la sensibilité baroré-
flexe à une augmentation du risque d’arythmie implique la
composante vagale du baroréflexe [11]. En situation d’is-
chémie myocardique chez le chien, il existe aussi une
forte corrélation entre l’ampleur de la réduction de la
cadence sinusale, la préservation de la sensibilité du baro-
réflexe et la réduction de la survenue de fibrillation ven-
triculaire [12].
En pratique, la qualité du baroréflexe s’évalue à l’aide
d’un agent vasoconstricteur alpha-adrénergique pur, la
phényléphrine [13]. L’allongement des intervalles RR suc-
cessifs obtenu avec cette médication est corrélé aux modi-
fications des changements de pression artérielle. Une
fenêtre d’analyse est sélectionnée entre le début et la fin de
la première augmentation significative de la pression arté-
rielle (supérieure à 15 mmHg). Habituellement l’allonge-
ment du cycle produit par une augmentation de 1 mmHg
de pression est utilisé pour quantifier le contrôle baroré-
flexe de la fréquence cardiaque. Chez les sujets jeunes,
des valeurs moyennes de sensibilité baroréflexe de
14,8 ± 9,2 ms/mmHg et de 16 ± 1,18 ms/mmHg ont été
rapportées [13]. Dans l’étude ATRAMI, qui a inclus
1 284 patients, la mortalité cardiaque calculée pendant
un suivi de 21 mois était plus importante chez les patients
avec une sensibilité baroréflexe inférieure à 3 ms/mmHg
que chez ceux où cette valeur dépassait 6,1 ms/mmHg
[13]. Cependant, ce paramètre n’est pas spécifique de la
mort subite mais plutôt lié au risque de mortalité globale.
Autres méthodes d’analyse
de la fonction sinusale
D’autres moyens de quantification de la variabilité
sinusale ont été développés récemment. Ces techniques
nouvelles restent à valider. Il s’agit de la dynamique non
linéaire (chaos) ou de l’étude de la puissance spectrale de
la variabilité sinusale. À l’opposé de ces techniques so-
phistiquées, maîtrisées par un petit groupe d’experts, une
étude a montré que la simple mesure de la récupération
sinusale post-effort permettait de stratifier le risque de
mortalité globale post-infarctus [14].
Dépolarisation ventriculaire
L’intervalle QRS représente la sommation des phases 0
du potentiel d’action des myocytes ventriculaires. Il peut
renseigner sur la qualité de la conduction de l’influx
électrique à travers le syncytium myocardique.
À l’échelon cellulaire, entrent en jeu non seulement les
propriétés électrophysiologiques des cellules musculaires
mais aussi leur agencement dans l’espace et la qualité des
jonctions entre elles [15]. En général, un allongement de
la durée du QRS, en dehors d’une anomalie du tissu de
conduction, révèle une atteinte du myocarde d’origine
toxique vasculaire, infectieuse ou métabolique.
Les études d’analyses de la mesure de la dépolarisation
ventriculaire restent peu nombreuses. L’outil le plus utilisé
a été l’ECG haute résolution. Cette technique permet,
grâce à la recherche de potentiels tardifs, l’identification
des zones de conduction ventriculaire lente et donc, pour
le patient qui en est porteur, d’un risque de tachycardie par
réentrée [16]. Il est admis que la présence de ces potentiels
a une mauvaise spécificité mais une bonne valeur prédic-
tive négative du risque rythmique [17]. Nous avons évalué
l’analyse par ondelettes des complexes QRS à partir d’en-
registrements numériques 12 dérivations chez des pa-
tients à risque d’arythmie [17]. L’analyse a été réalisée à
partir d’un électrocardiogramme haute résolution
(1000 Hz, 16 bits). Les résultats préliminaires montrent
que cette méthode peut distinguer les patients à risque
d’arythmie ventriculaire en cas de syndrome du QT long
(figure 1), de dysplasie arythmogène du ventricule droit et
d’infarctus du myocarde [18]. La cartographie haute-
densité a aussi été utilisée avec succès pour l’identifica-
tion d’anomalie de la propagation de l’influx chez les
patients avec fibrillation ventriculaire primaire [19].
Repolarisation ventriculaire
Bien que l’intervalle QT englobe à la fois la dépolari-
sation et la repolarisation ventriculaires, sa mesure est
utilisée pour quantifier la repolarisation ventriculaire [20].
Un retard de repolarisation correspond à un allongement
de l’intervalle QT. À l’échelon cellulaire, il existe un ralen-
tissement de l’extrusion des cations intracellulaires (potas-
sium ou sodium) vers l’extérieur de la cellule. La simple
mesure statique d’un intervalle QT est considérée comme
insuffisante pour éliminer un risque électrique chez un
patient donné [21]. L’analyse dynamique battement par
battement ou par période de 30 secondes est actuellement
en évaluation comme indice d’arythmogénicité [22].
L’analyse de la dispersion de l’intervalle QT est une mé-
thode qui n’est plus utilisée [21]. Bien qu’il y ait une
relation proportionnelle entre le degré d’hétérogénéité des
périodes réfractaires ventriculaires et le seuil arythmo-
gène, l’étude de la dispersion ventriculaire par méthode
ECG conventionnelle reste décevante.
Dynamique de l’intervalle QT
Il est établi que l’intervalle QT est dépendant de la
fréquence cardiaque. La relation entre l’intervalle RR et
l’intervalle QT peut être étudiée de façon plus complète
que la simple mesure par la méthode de Bazett [23]. La
mt cardio, vol. 1, n° 3, mai-juin 2005 231
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

mesure dynamique de l’intervalle QT à partir d’un enre-
gistrement Holter nécessite des procédures automatiques
limitées par la détermination difficile de la fin de l’onde T,
notamment à des fréquences rapides [22]. La dépendance
de l’intervalle QT à la fréquence cardiaque peut être
évaluée grâce à une équation de régression linéaire entre
les intervalles QT et les intervalles RR correspondants dans
des fenêtres de temps pré-sélectionnées [21]. Le segment
de la repolarisation qui va jusqu’à la fin de l’onde T (QT
end) est soumis aux variations de la balance sympathova-
gale contrairement à l’intervalle qui se mesure jusqu’au
sommet de l’onde T (QT apex). En général, une pente
prononcée de l’intervalle QT/RR indique une dépendance
très forte de l’intervalle QT à la cadence sinusale avec une
prolongation importante à des cycles longs et un raccour-
cissement à de cycles plus courts [22]. À l’inverse, une
pente moins prononcée indique que l’intervalle QT est
moins dépendant du cycle cardiaque et ne se raccourcit
pas à des cycles plus courts. La pente QT/RR est plus
prononcée chez certains patients avec syndromes du QT
long congénital et ceux à risque de mort subite après
infarctus du myocarde (figure 2).
Variabilité et alternance de l’onde T
L’alternance de l’onde T est caractérisée par un chan-
gement 2/1, battement à battement, dans la forme, l’ampli-
tude et occasionnellement la polarité de la repolarisation
ventriculaire. Il semble exister une association significa-
tive entre la présence de cette anomalie et la survenue
d’arythmies ventriculaires. L’alternance de l’ondeTaété
identifiée principalement chez les patients avec syndrome
du QT long congénital ou acquis, mais aussi à l’occasion
d’ischémie myocardique aiguë ou d’hypomagnésémie
[24].
La variabilité de l’onde T est caractérisée par des
changements battement à battement dans la morphologie
de la repolarisation, mais sans l’aspect 2/1 typique de
l’alternance. L’association entre la variabilité de l’onde T
et le risque de mort subite est moins documentée que celle
concernant l’alternance de l’onde T [25].
0,00001
0,0001
0,001
0,01
0,05
0,05
0,01
0,001
0,0001
0,00001
184-250
155-211
131-178
110-150
91-125
78-106
66-88
55-74
44-62
40-52
-100
Bande de fréquence (Hz)
Valeur de p
-50 0 50 100 150 200 250
1
2
3
4
5
6
7
8
9
10
-100 -50 0 50 100 150 200 250
1
2
3
4
5
6
7
8
9
10
-100 -50 0 50 100 150
Temps (ms)
200 250
1
2
3
4
5
6
7
8
9
10
-100 -50 0 50 100 150 200 250
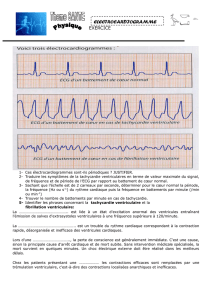
Figure 1.Analyse de la dépolarisation ventriculaire (intervalle QRS) à l’aide de la technique des ondelettes. Après enregistrement haute-
résolution, une population de patients avec syndrome du QT long congénital est comparée à une population de sujets sains. Les zones colorées
en jaune contiennent le signal électrique qui différencie les deux groupes. Ces anomalies siègent au tout début du complexe QRS représenté par
le premier trait vertical. Il existe donc des anomalies de la dépolarisation ventriculaire chez les patients avec QT long congénital. L’ECG
conventionnel ne permet pas l’identification de ce marqueur du risque électrique ventriculaire.
Nouveaux marqueurs du risque de mort subite d’origine rythmique
mt cardio, vol. 1, n° 3, mai-juin 2005
232
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Les mécanismes électrophysiologiques qui sous-
tendent la variabilité et l’alternance de l’onde T sont mal
connus. La relation entre la durée de la repolarisation et la
longueur du cycle détermine la probabilité de survenue de
l’alternance de l’onde T. Une hétérogénéité trop pronon-
cée de la repolarisation ventriculaire contribue aussi à
l’émergence de l’alternance de l’onde T. À l’échelon cel-
lulaire, une cinétique anormale de l’ion calcium peut
expliquer une augmentation de l’hétérogénéité transmu-
rale de la durée des potentiels d’action [25]. Les médica-
ments calcium-bloqueurs, comme le vérapamil, dimi-
nuent l’alternance de l’onde T et peuvent prévenir la
fibrillation ventriculaire, notamment en cas d’ischémie
myocardique [26].
La technique actuelle la plus utilisée pour identifier ce
paramètre à l’échelle du microvolt est une méthode spec-
trale. Les changements de l’onde T peuvent être représen-
tés comme la puissance spectrale des fluctuations d’am-
plitude battement par battement d’une série de complexes
QRS consécutifs. La méthode spectrale est utilisée pour
détecter la variabilité de l’onde T pendant l’épreuve d’ef-
fort avec un système actuellement commercialisé (Cam-
bridge, MA). Après ajustement de la variabilité battement
par battement, de la dérive de la ligne de base et de la
modulation de la respiration, un indice d’alternance est
calculé pour chaque onde T. Le test est considéré comme
positif lorsque l’amplitude de l’alternance dépasse 1,9 mi-
crovolts [27].
L’analyse de la variabilité de la repolarisation dans le
domaine temporel est fondée sur la définition d’un indice
de corrélation de la repolarisation. Cet indice de corréla-
tion compare chaque onde T consécutive avec une onde T
médiane et renseigne sur la complexité des oscillations de
l’onde T. L’avantage de cette technique est qu’elle ne
nécessite pas d’identification de l’apex ou de la fin de
l’onde T. De plus, cette méthode permet une quantifica-
tion des changements battement par battement pour l’en-
semble du segment de repolarisation. La signification pro-
nostique des résultats de cette nouvelle méthode est en
cours d’évaluation (Docteur Maison-Blanche, hôpital La-
riboisière).
Analyse 3D de la repolarisation ventriculaire
Pour l’analyse spatiale de la repolarisation ventricu-
laire, le système CAVIAR (Comparaison automatique des
vectocardiogrammes et leur interprétation par auto-
référence) a été mis au point à Lyon [28]. Il permet
d’élaborer de nouvelles mesures quantifiant le degré
QT (ms)
700
650
600
550
500
450
400
350
300
250
200
150
100
400 600 800 1000 1200 1400 1600
QTe/RR = 0,23
r = 0,827
QTa/RR = 0,16
r = 0,863
RR (ms)
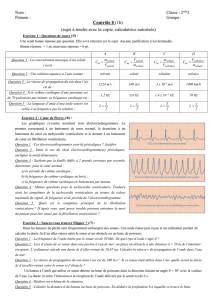
Figure 2.Exemple d’analyse de la dynamique de l’intervalle QT chez un patient avec infarctus du myocarde compliqué de tachycardie
ventriculaire. La pente de l’intervalle QTe est anormalement élevée (p = 0,23) alors que celle de l’intervalle QTa est moins prononcée et reste
dans les limites de la normale.
mt cardio, vol. 1, n° 3, mai-juin 2005 233
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
1
/
7
100%