Diapo

Quel diagnostic évoquez-vous ?
1) Quelle est la bactérie responsable ?
2) Comment le patient s’est infecté ? Vous décidez de l’hospitaliser, quelles
mesures prenez-vous?
3) Quelle est la physiopathologie de la maladie et le pouvoir pathogène de la
bactérie?
4) Quel(s) examen(s) demandez-vous pour étayer votre diagnostic étiologique?
5) Quelles vont être les étapes du diagnostic bactériologique ?
6) Quels résultats attendez-vous pour confirmer votre diagnostic?
7) Quels antibiotiques vont être testés?
8) Quels examens de laboratoires demandez-vous pour le suivi?
Un homme âgé de 40 ans, Malien vivant en Foyer, en France depuis 6 mois,
• consulte pour fièvre intermittente, toux et dyspnée, altération de l’état général,
amaigrissement de 5 kg depuis 1 mois
• Radio de thorax = présence d’une opacité dans l’apex gauche mal systématisée
TD-ED DCEM 1 Bactériologie R. Ruimy
Propriété de la Faculté de Médecine Université Paris 7-Denis Diderot

Votre suspicion de tuberculose est forte devant :
-patient récemment arrivé en France et venant d’un pays
à forte endémie
-vivant dans des conditions socio-économiques difficiles
- symptomatologie respiratoire la fièvre prolongée
intermittente depuis 1 mois
- recherche des sueurs nocturnes assez typiques
- amaigrissement
- résultat de la Radio de thorax
1) Quel diagnostic évoquez-vous ?

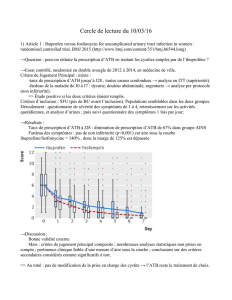
Caractéristiques des malades tuberculeux
bactériologiquement prouvés en France en 2002
(n=1528)
• 65% : hommes
• 54% : nés à l’étranger
• 57% : entre 25 et 59 ans
• 10% : séropositifs pour le VIH
• 71% : tuberculose pulmonaire isolée
• 21% : tuberculose extra-pulmonaire isolée
• 8% : tuberculose mixte
• 40% : examen microscopique positif
Résultat enquête nationale groupe AZAY

2) Quel est la bactérie responsable
de la tuberculose ?
Mycobacterium tuberculosis
sensu stricto (Bacille de Koch : découvreur)
(BK) pathogène spécifique de l’homme le plus fréquent,
Mycobacterium africanum
variant de
M. tuberculosis
que l’on peut
isoler de patient africain
Mycobacterium bovis
pathogène des bovidés ⇒tuberculose bovine,
L’homme peut s’infecter par absorption de lait cru ou au contact des
animaux, bien contrôlé dans nos régions,
c’est à partir d’une souche de
bovis
repiquée pendant 13 ans
= souche atténuée, appelée BCG (Bacille de Calmette et Guérin)
Regroupées sous le terme de
mycobactéries du complexe tuberculosis, Famille des
Mycobacteriaceae.

3) Comment le patient s’est infecté ? Vous décidez
de l’hospitaliser quelles mesures prenez-vous ?
-Isolement respiratoire du patient
-Chambre seule, porte fermée, pression négative
-Port de masque obligatoire pour toute personne
entrant dans la chambre
Transmission de la tuberculose est inter-humaine.
......
...
.
........
.
.
.
.
..
.
.......
...
.
.
.
....
....
.
Sujet tuberculeux Sujet contact
goutelettes
Lésion de
tuberculose
pulmonaire
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%