Aliments source de protides

L
LE
ES
S
P
PR
RO
OT
TI
ID
DE
ES
S
Introduction : Aliments source de protides ?
Les protides sont trouvés principalement dans deux groupes d’aliments :
les viandes, poissons et œufs
les légumes secs (lentilles, haricots secs, pois chiches…et soja) Rôle ?
Les protides sont les constituants fondamentaux (du grec protos : premier) de la matière
vivante. Ce sont de grosses molécules qui ont un rôle structural mais surtout
fonctionnel (enzymes, hormones, anti-corps…)
Ils sont utilisés en dernier recours pour fournir à l’organisme de l’énergie.
I) CLASSIFICATION DES PROTIDES.
1) Constitution des protides.
a) Les acides aminés
Les acides aminés constituent l'unité structurale des protides. Ils sont composés de 4 à 5
atomes différents : C, H, O, N, S.
Représentation d’un acide aminé :
H2N – CH – COOH
R
TRANSPARENT
R est variable et plus ou moins complexe selon les acides aminés.

Les protides sont composées d'une vingtaine d'acides aminés seulement, toujours les mêmes.
DOCUMENT - Tableau des acides aminés
Chaque protéine est caractérisée par le nombre d'acides aminés qui la constituent (de 2 à
4000) et par la séquence des acides aminés.
Acide aminé indispensable ou essentiel : Acide aminé que notre organisme ne peut pas
synthétiser (ou qu'il ne peut synthétiser que trop lentement pour répondre aux besoins de
l'organisme) ; ces acides aminés doivent donc être apporté par l'alimentation. Chez l'adulte, 8
acides aminés sont dits «indispensables» : isoleucine, leucine, lysine, méthionine,
phénylalanine, thréonine, tryptophane et valine. L’histidine est également indispensable chez
le nourrisson.
b) La liaison peptidique TRANSPARENT
Deux acides aminés vont se lier grâce à leur fonction amine et leur fonction acide :
COOH + NH2 = CONH + H2O
On parle de : Liaison peptidique
CH CO NH CH
R1 R2
Ainsi on peut créer un dipeptide et, en allongeant la chaîne, un polypeptidique.
2) Structures des protides.
TRANSPARENT – DOCUMENT
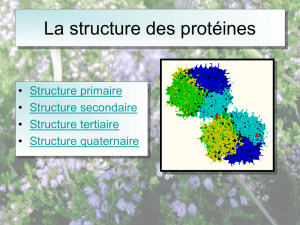
a) Structure primaire
C’est une simple chaîne d’acides aminés ; les acides aminés sont liés les uns aux autres par
une liaison peptidique.
b) Structure secondaire
La chaîne s’enroule en hélice ou en feuillet stabilisé par des liaisons hydrogènes (liaisons
faibles)

c) Structure tertiaire
Les hélices s’enroulent et interagissent entre elles : on parle de structure globulaire. Ce sont
alors des molécules très volumineuses.
d) Structure quaternaire
Associations de plusieurs structures globulaires en structure tertiaire.
Remarques : Cette structure très enroulée sur elle-même implique une digestion difficile des
protéines. Notre système digestif, pour digérer ces nutriments, doit tout d’abord dérouler la
structure avant de pouvoir libérer un à un les acides aminés.
II) PROPRIETE DES PROTIDES.
1) Solubilité
Les protides dans l’eau, s’hydrate, gonfle et rend le milieu visqueux.
2) Dénaturation des protéines - gélification
La dénaturation est une désorganisation de toutes les structures à liaisons faibles. Les chaînes
protéiques se déroulent et puis s’organisent en réseau environné d’eau.
Les agents dénaturants sont :
a) La température
La chaleur modifie la structure secondaire et tertiaire des protides. Elles forment alors un gel
solide : gel de gélatine (hydrolyse du collagène), coagulation du blanc, gélification de
protéines dans la pâtes boulangères, …
Exemple : cuisson d’un œuf : le blanc liquide se durcit

Lorsque la température approche des 60°C, l'agitation atomique devient telle que les
liaisons les plus faibles -comme les liaisons hydrogène- se rompent : c'est la dénaturation
(les structures seconde, tertiaire et quaternaire sont détruites, seule la structure primaire
n’est pas modifier). La protéine se déroule.
Les molécules protéiques vont s’associer entre eux mais également avec les molécules
d'eau : c'est la coagulation. L'ovalbumine dénaturée s'entoure d'une gaine de molécules
d'eau, augmentant ainsi le volume de la protéine et diminuant sa mobilité.
b) Le ph
Acides et bases interviennent sur les liaisons ioniques des protéines.
Exemple : l’attendrissement des viandes, les marinades, le carpaccio (par dénaturation du
collagène), les yaourts (l’acide lactique produit par les ferments lactiques, dénature les
caséines du lait).
3) Propriété moussante-émulsifiante
Blanc d’œuf = albumine + eau
Le fouet dénature les protéines et incorpore
de l’air dans la solution d’albumine
Les protéines dénaturées s’insèrent à
l’interface air/eau et forment un film qui
stabilise la mousse
4) Valeur nutritionnelle
Les protides sont fournisseurs d’énergie.
1 g de protide sera transformé par l’organisme en 17 KJ
(1KJ = 4.18 Kcal)
III) QUALITE DE LA RATION PROTIDIQUE.
L’organisme humain ne sait pas fabriquer certains acides aminés. Ainsi pour fabriquer ses
propres protéines, il faudra qu’il trouve ces acides aminés dans son alimentation. On parle
d’acides aminés essentiels.
Certaines aliments comme la viande, le poisson contiennent des protéines de bonne qualité :
c’est à dire que ces protéines contiennent beaucoup de ces acides aminés essentiels.
D’autres aliments sont riches en protéines, les légumes secs, mais ont des protéines de qualité
médiocre : c’est le cas des légumes secs.

Les protéines de meilleure qualité sont trouvés dans les œufs : c’est l’ovalbumine. La protéine
de l'œuf a été choisie comme protéine de référence car elle constitue le standard du parfait
équilibre en acides aminés.
Il faut dans notre alimentation assurer une complémentation protidique, c’est à dire fournir à
l’organisme dans une même journée des aliments qui lui amèneront différentes protéines qui
couvriront l’apport en acides aminés essentiels.
1
/
5
100%