Les thromboses veineuses cérébrales

52 | La Lettre du Neurologue • Vol. XVII - n° 2 - février 2013
MISE AU POINT
Les thromboses veineuses
cérébrales
Cerebral venous thrombosis
F. Macian-Montoro*
* Unité de neurologie vasculaire,
hôpital Dupuytren, Limoges.
L
es thromboses veineuses cérébrales (TVC) ont
été décrites dès le xix
e
siècle (1). Si, par le passé,
l’étiologie infectieuse était prédominante et
le pronostic redoutable (2), les étiologies princi-
pales sont aujourd’hui aseptiques et le pronostic
est bon (3). La prise en charge a été améliorée par
l’utilisation de l’IRM et des traitements anticoagu-
lants (1, 4, 5).
Il s’agit d’une pathologie plutôt rare (1, 3, 6-8),
concernant 3 à 5 cas par million d’habitants, soit
environ 0,5 % du total des accidents vasculaires
cérébraux (AVC) [1, 3, 5, 7]. Elle reste plus fréquente
et avec une mortalité plus élevée dans les pays en
voie de développement, où elle est associée à la
pathologie puerpérale (3). Le sex-ratio femme-
homme est de 3:1 (3, 8) chez l’adulte jeune, en raison
de l’association à la grossesse et au post-partum, et
de l’utilisation de contraceptifs oraux (6). Cette diffé-
rence s’annule pour les autres tranches d’âge. C’est
une pathologie du sujet jeune comparativement aux
AVC d’origine artérielle (1, 3, 7, 8).
Une physiopathologie
complexe
La physiopathologie reste difcile à appréhender.
Deux mécanismes expliquent la symptomatologie
et le mode d’installation (6, 8).
➤
L’obstruction veineuse, avec augmentation de la
pression capillaire et dysfonction du parenchyme.
Elle peut être responsable d’hémorragies. En fonction
de la disposition veineuse et des voies de drainage
collatérales, on peut voir apparaître un œdème vaso-
génique (potentiellement réversible) ou cytotoxique,
responsable de lésions parenchymateuses.
➤
L’augmentation de la pression intracrânienne
(PIC) par l’œdème et le déficit de résorption du
liquide céphalorachidien (LCR) par les granulations
arachnoïdiennes.
Ces processus se combinent à un degré variable
en fonction du patient et de son état veineux, ce
qui explique la variabilité clinique (4) et la présen-
tation, souvent imprécise. De ce fait, le diagnostic
est fréquemment retardé par rapport à l’apparition
des premiers signes cliniques (1, 8).
Une présentation variée…
Le spectre clinique (tableau I) est donc très
large (6, 8) et peut mimer beaucoup d’affec-
tions neurologiques aiguës (1, 3). Les symptômes
classiques sont des céphalées, des crises d’épilepsie,
des décits focaux, des troubles de la conscience et
un œdème papillaire. Ces signes se regroupent en
quelques tableaux classiques (1) :
➤hypertension intracrânienne (HIC) ;
➤
signes neurologiques focaux (épileptiques ou
décitaires) ;
➤
manifestations en faveur d’une encéphalopathie
aiguë ;
➤
ou une combinaison des 3 éléments précé-
dents.
Ces signes sont fonction de l’âge, du sexe, du
temps entre l’apparition des premiers symptômes
et l’examen clinique, du type et de la localisation de
l’atteinte parenchymateuse, du sinus et du niveau de
la thrombose. Dans 30 % des cas, le début est aigu
(< 48 heures), ce qui est fréquent en cas d’étiologie
infectieuse ou obstétricale ; dans 50 % des cas, la
présentation est subaiguë (48 heures à 30 jours) ;
et dans 20 % des cas, l’installation est insidieuse,
de 30 jours jusqu’à plusieurs mois, en rapport avec
un tableau d’HIC (fréquent dans les causes inam-
matoires) [3, 8].

La Lettre du Neurologue • Vol. XVII - n° 2 - février 2013 | 53
Résumé
La thrombose veineuse cérébrale est une pathologie rare, touchant plutôt des femmes jeunes en raison
de l’association à des facteurs hormonaux.
Elle doit être évoquée devant un tableau de céphalées sans diagnostic précis ou de présentations vas culaires
atypiques.
Le diagnostic est aisé grâce aux nouvelles techniques d’imagerie par scanner ou IRM, mais le diagnostic
étiologique nécessite un bilan exhaustif qui reste souvent négatif.
Le pronostic des thrombophlébites cérébrales est bon sous traitement anticoagulant bien conduit, etletaux
de récidive est plus faible que pour les accidents d’origine artérielle.
Mots-clés
Thrombose veineuse
cérébrale
Accident vasculaire
cérébral
Céphalée
Anticoagulation
Pronostic
Summary
Cerebral venous thrombosis is
an uncommon cause of stroke
especially in young women.
It should be considered in
young patients who present
with unusual headache or
atypical focal signs or seizures.
Abnormal signal in a vein and
absence of flow in venography
conrms the diagnosis on MRI
or CT-SCAN. The search of the
cause necessitates an exten-
sive work-up, often nega-
tive. Outcome is good with
anticoagulant treatment and
recurrence rate lower than for
arterial stroke.
Keywords
Cerebral venous thrombosis
Ischemic stroke
Cephalalgia
Anticoagulant
Prognostic
… Et des étiologies multiples
Du fait de la multiplicité des facteurs de risque
(tableau II, p. 54), le bilan diagnostique doit être
exhaustif dès le début de la prise en charge (1). Si
1 des facteurs de risque est retrouvé chez 85 % des
patients (3, 6, 8), il y en a au moins 2 dans plus
de 40 % des cas (3). Une thrombophilie congé-
nitale ou génétique est associée dans plus de 20 %
des cas (3, 4, 8). Même si aucune étiologie n’est
retrouvée dans 15 % des cas (1) [jusqu’à 37 % dans la
population âgée], il semble important de poursuivre
cette recherche étiologique au-delà de la phase
aiguë, car certains états pathologiques peuvent
n’apparaître que pendant le suivi (troubles de la
crase sanguine, cancer, etc.). Le facteur de risque
le plus fréquent est la prise de contraceptifs oraux.
Dans les autres cas, l’étiologie est dominée par les
états prothrombotiques, génétiques ou acquis (3).
Un diagnostic facilité par l’IRM
La maladie doit être soupçonnée devant un patient
jeune, présentant une céphalée inhabituelle, un
AVC sans facteur de risque précis et connu ou une
atteinte multiple (d’autant plus s’il s’y associe des
lésions hémorragiques). La conrmation nécessite
une imagerie (6-8) qui montre l’absence de ux
dans une veine, la thrombose intraluminale et
l’atteinte parenchymateuse (1, 7). L’utilisation de
l’IRM a radicalement changé cette étape diagnos-
tique (5), car si le scanner permet d’exclure d’autres
pathologies ou de visualiser les hémorragies, il reste
négatif jusqu’à 30 % des cas (7). La technique de
veinographie par scanner peut être une alternative
à l’IRM (1, 5, 7, 8) en cas de contre-indication ou lors
de situations particulières (dans les cas très précoces
ou très tardifs dans lesquels les signaux T1 et T2 ne
sont pas spéciques) avec une sensibilité de 95 % et
Tableau I. Présentation clinique.
Symptômes Caractéristiques
Céphalée 90 % des cas (+++ femme jeune)
Plutôt localisée, sans relation avec le sinus thrombosé
Installation plus souvent progressive qu’aiguë
Si HIC associée : sévère, diffuse, s’aggravant au Valsalva, avec signes visuels
Dans 15 % des cas, elle est isolée ou pouvant mimer d’autres pathologies (hémorragie
sous-arachnoïdienne, migraine, etc.) [problème diagnostique]
Épilepsie 40 % des cas
Généralisée ou partielle
Associée aux lésions parenchymateuses (souvent par thrombose du sinus longitudinal ou
atteinte des veines corticales)
Signes focaux 30 à 50 % des cas
Les plus fréquents sont les signes moteurs et l’aphasie par atteinte du sinus latéral
Encéphalopathie Altération de la conscience, dysfonction cognitive, apathie : signes aspéciques
Tableaux cliniques en fonction du sinus thrombosé (par ordre de fréquence)
SLS
(sinus longitudinal supérieur)
Signes moteurs fréquents, parfois bilatéraux, épilepsie HIC isolée et rare
SL
(sinus latéral)
Céphalée et/ou HIC isolées
Aphasie
Système profond
(veines cérébrales internes,
basales, sinus droit)
Signes plus sévères ; troubles de la conscience, coma ; signes bilatéraux plus fréquents
Veines corticales Décits moteurs ou sensitifs isolés, épilepsie ; HIC rare
Sinus jugulaire Acouphènes ; atteinte possible des nerfs crâniens
Sinus caverneux Signes oculaires au premier plan : douleurs, proptosis, chémosis et ophtalmoplégie

54 | La Lettre du Neurologue • Vol. XVII - n° 2 - février 2013
Les thromboses veineuses cérébrales
MISE AU POINT
Tableau II. Facteurs de risque de la thrombose veineuse cérébrale.
Transitoires Permanents
Grossesse et post-partum Maladies inflammatoires
Vascularites : lupus, maladie de Behçet, maladie de Wegener
Sarcoïdose
Maladies inflammatoires intestinales
Maladies infectieuses Néoplasies
SNC : abcès, empyème, méningite
ORL : face, cou
Systémiques : septicémie, endocardite, etc.
SNC : méningiome, métastases, inltrations malignes
Viscérales
Leucémies – lymphomes, syndromes myéloprolifératifs
Facteurs mécaniques Pathologie hématologique
Traumatisme crânien
Ponction lombaire
Cathétérisme/compression jugulaire
Intervention neurochirurgicale
Polycytémie
Thrombocytémie
Anémie : drépanocytose, HPN, hémorragie, etc.
Médicaments
Contraceptifs oraux/THS
Stéroïdes
Chimiothérapie
Autres situations
Déshydratation sévère
au décours d’un AVC
Cardiopathies (+++ congénitales)
MAV/FAV
Troubles de la coagulation
Décit en antithrombine III
Décit en protéines C et S
Mutation du facteur V Leiden
Mutation du facteur II (G2021A)
Décit en plasminogène
Hyperhomocystéinémie/homocystinurie
Coagulation intravasculaire disséminée
Excès de facteur VIII
Syndrome néphrotique
Syndrome des antiphospholipides
Anticoagulants lupiques
Sont considérés comme thrombophilie modérée : les mutations à l’état hétérozygote et l’élévation du facteur VIII. La
thrombophilie sévère concerne le décit de protéines de la coagulation, les mutations homozygotes, la présence d’anticorps
antiphospholipides ou la combinaison de ces facteurs.
SNC : système nerveux central ; THS : traitement hormonal substitutif ; HPN : hémoglobinurie paroxystique nocturne ; MAV : malformation artérioveineuse ;
FAV : stule artérioveineuse.
Tableau III. Principaux signes radiologiques des thromboses veineuses cérébrales.
Scanner IRM
Signes directs Thrombus
Signe de la corde 25 % des cas
Peu spécique (ux lents)
J1-J5 : iso-intense en T1 ;
hypo-intense en T2
Signe du delta 60 % des cas de thrombose du SLS
Fréquents faux positifs
J5-J30 : hyperintense en T1 et T2
Signe du delta vide 30 % des cas (injection de produit
decontraste)
T2* : hypo-intense avec artéfact de susceptibilité magnétique
Absence de visualisation ou d’opacication du sinus
enangiographie IRM
Signes indirects Lésions parenchymateuses
Altérations oreille moyenne/mastoïde
Hydrocéphalie, compression IVe ventricule
Infarctus/hémorragie cérébrale
Diminution de la taille ventriculaire (par l’œdème)
Œdème vasogénique ou cytotoxique : hyperintensité T2
etDWI
Hémorragie : hyperintensité T1-T2, hypo-intensité T2*

La Lettre du Neurologue • Vol. XVII - n° 2 - février 2013 | 55
MISE AU POINT
une spécicité de 91 % (7). L’IRM reste néanmoins
l’examen de choix. Le protocole classique inclut des
séquences T1 avec et sans contraste, T2, FLAIR, et
des séquences veineuses avec ou sans contraste
(tableau III).
Qu’en est-il des “nouvelles séquences
vasculaires” ?
La séquence de diffusion − largement utilisée en
pathologie artérielle − montre souvent un œdème
vasogénique, parfois cytotoxique, mais reste
d’interprétation difcile en raison des nombreux
aspects possibles (1, 7). La séquence T2* est utile
pour identifier les hémorragies parenchyma-
teuses de petite taille, mais surtout, en raison des
artéfacts de susceptibilité magnétique, pour visua-
liser le thrombus dans un sinus ou dans une veine
corticale (1). Les différentes techniques d’imagerie
de coupe sont exposées à de nombreux pièges (1, 7) :
➤
variations anatomiques des sinus et des veines
corticales ;
➤
atrésie ou hypoplasie (fréquente dans le sinus
latéral et la partie antérieure du SLS) ;
➤
duplication d’un sinus (partie antérieure du SLS) ;
➤asymétrie du ux ;
➤
présence de septums veineux ou de granulations
arachnoïdiennes.
C’est pourquoi l’angiographie, autrefois consi-
dérée comme le gold standard, garde encore une
place pour conrmer des cas fortement suspects
pour lesquels l’imagerie de coupe est négative ou
douteuse (1, 3, 8). L’intérêt potentiel du doppler
transcrânien n’est pas encore démontré en pratique
clinique courante (7).
Des examens biologiques
pour la recherche étiologique
Les examens biologiques gardent un rôle dans le
diagnostic étiologique (tableau II). Même si, en
cas de thrombophlébite périphérique, le taux de
D-dimères a une bonne valeur prédictive négative (1),
son intérêt dans la TVC est beaucoup plus discu-
table (3, 7, 8). La réalisation d’une ponction lombaire
ne se justie qu’en cas de suspicion de méningite,
car elle trouve souvent (dans 30 à 50 % des cas) une
pléiocytose, la présence de globules rouges et une
hyperprotéinorachie non spéciques (7). La recherche
d’un état prothrombotique nécessite souvent des
examens de conrmation à distance, car (7) :
➤
la thrombose aiguë peut réduire les taux de
protéines C-S et d’antithrombine ;
➤le traitement anticoagulant induit des change-
ments de ces protéines (l’héparine réduit les niveaux
d’AT-III, les AVK ceux des protéines C-S, tout en
augmentant l’AT-III).
Un examen de contrôle est donc nécessaire, au
moins 2 semaines après l’arrêt de l’anticoagulation.
Les résultats anormaux d’anticoagulants lupiques,
d’anticardiolipine ou d’anti-β2 glycoprotéine-1
doivent être conrmés à 12 semaines d’intervalle
pour être considérés comme signicatifs.
Le traitement
Le traitement passe par celui de la cause sous-jacente
(notamment l’utilisation d’antibiotiques pour les
causes infectieuses) [7], ce qui est relativement aisé
pour les causes transitoires et parfois compliqué
pour les pathologies chroniques. En dehors de ce
traitement, les objectifs sont de recanaliser la veine
occluse, d’empêcher la propagation du thrombus,
la thrombose à distance et le traitement sympto-
matique.
À la phase aiguë
◆Traitement symptomatique
Le traitement symptomatique concerne plusieurs
éléments.
➤La douleur (antalgiques) et l’agitation.
➤
L’HIC, par des mesures positionnelles, la séda-
tion, des diurétiques osmotiques, une hyper-
ventilation avec monitorage de la PIC en service
de soins intensifs. L’utilisation de glucocorticoïdes
n’a pas démontré de bénéce dans cette indica-
tion (3, 5, 7). Parfois, l’évacuation d’un hématome
ou une craniectomie décompressive peut s’avérer
nécessaire (5-7, 9).
Les crises d’épilepsie : il n’existe pas de bénéce
évident à une prophylaxie systématique (5), ni de
consensus concernant l’utilisation d’antiépilep-
tiques. En cas de lésion corticale associée ou de
crise inaugurale, l’utilisation d’antiépileptiques peut
diminuer la fréquence des crises. Il faut privilégier
les médicaments ayant une faible interaction avec
les anticoagulants (valproate, nouvelles molécules).
◆Traitements antithrombotiques
L’anticoagulation est le traitement de choix à
commencer le plus vite possible (5, 7, 10), par
de l’héparine non fractionnée (en visant un aPTT

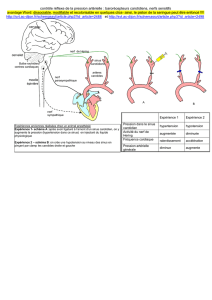
Figure.
A1. Scanner cérébral sans injection du produit de contraste : signe du delta (flèche). A2. Scanner cérébral avec injection du produit de contraste :
signe du delta vide (flèche).
B1. IRM en séquence FLAIR : thrombose des veines corticales (flèches). B2. IRM en séquence de diffusion : ischémie corticale en regard de la veine
thrombosée.
C. Séquences IRM standard. C1. T1 : thrombose du SLS. C2. T2 : thrombose du SLS. C3. T2* : hémorragie thalamique par occlusion du système profond.
C4. Séquences veineuses avec absence du SL et sigmoïde gauche (flèches).
A1
C1
A2
C2
B1
C3
B2
C4
56 | La Lettre du Neurologue • Vol. XVII - n° 2 - février 2013
Les thromboses veineuses cérébrales
MISE AU POINT
malade/témoin entre 2 et 3) ou des héparines de bas
poids moléculaire (HBPM) avec des doses adaptées
au poids. Les méta-analyses concernant les essais
avec ces molécules suggèrent que ce traitement
est associé à une réduction de la mortalité et de
la dépendance. Il n’augmente pas le risque hémor-
ragique, y compris en cas d’hémorragie cérébrale
avérée (3, 10, 11).
Les antiplaquettaires n’ont pas démontré leur ef-
cacité (7) et sont prescrits si l’anticoagulation est
contre-indiquée.
La thrombolyse par voie systémique ou locale
(urokinase, rt-PA ou thrombectomie mécanique) est
réservée aux cas s’aggravant malgré un traitement
anticoagulant bien conduit. Il n’existe pas d’essais
cliniques randomisés validant ces techniques, et les
études publiées ne concernent que les cas sévères
pour lesquels il est suggéré un possible bénéce
(3, 5, 7).
Après la phase aiguë
Certaines situations peuvent nécessiter un traitement
symptomatique particulier à long terme.
Les crises d’épilepsie : l’épilepsie complique 5 à 11 %
des TVC (5), surtout en cas de crise inaugurale ou
d’hémorragie cérébrale. Dans ces cas, il est recom-
mandé une durée de traitement de 1 an, mais la durée
optimale reste inconnue.
Les céphalées : des céphalées graves et persis-
tantes touchent plus de 14 % des patients (4, 5).
 6
6
1
/
6
100%