Ts t5ch1 corrections ex stereoisomerie 1

TS
Thème 5 : les molécules
SPC
Chap 1 : stéréoisomérie des molécules organiques
Ex2 p92
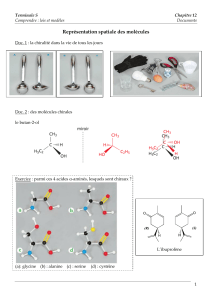
1. a : topologique ; b : semi-développée ; c : Cram ; d : semi-développée ; e : Cram ; f : topologique.
2. a : C3H60 ; b : C4H11N ; c : C3H7Cl ; d : HCN ; e : C6H14O ; f : C4H8O2.
3. La représentation de Cram.
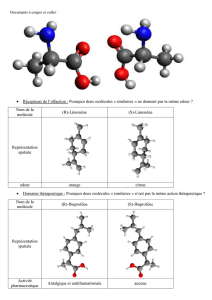
Ex3 p92
1. Acide aspartique : semi-développée.
Isoprène : semi-développée.
Acide lactique : Cram.
2.
Ex4 p92
Ex5 p93
1. Arrangement tétraedrique.
2.
Ex8 p93
1. Les atomes de carbone qui adoptent une géométrie tétraédrique sont engagés dans 4 liaisons simples. Ils sont repérés en
gris :
2.
Ex 12p94
C13H18O
C8H8O3
C8H14O2
a) chirale b) chirale c) achirale

Ex 14p94
1. et 2.
3. La molécule de citronellol est chirale, car elle possède un seul atome de carbone asymétrique.
Ex 15p95
Ex 17p95
1.a.
b. Les atomes de carbone tétraédriques repérés par une flèche ci-dessus sont liés à au moins deux atomes d’hydrogène, et
par conséquent, ne sont pas asymétriques.
2. La disposition spatiale des doublets autour des atomes de carbone asymétriques sont représentés à l’aide de la
représentation de Cram.
Ex 23 p96
1. [a] et [b] sont identiques.
2. [a] et [b] sont des conformations éclipsées, [c] est une conformation décalée.
3. La conformation la plus stable est la conformation [c] qui est une conformation décalée.

Ex 24p97
1.
2.a. libre rotation autour de la liaison carbone-carbone
b.
Ex25 p97
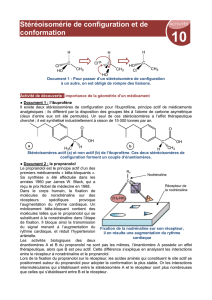
1. La conformation A est la conformation décalée.
La conformation B est la conformation éclipsée.
Par analogie avec la molécule d’éthane, la plus stable serait a priori la conformation décalée.
2. La liaison hydrogène qui s’établit entre l’atome de fluor et l’atome d’hydrogène permet de stabiliser la conformation
éclipsée, qui devient alors plus stable que la conformation décalée.
Ex26 p97
1. Il existe une infinité de conformations pour la molécule de butane obtenues par libre rotation des groupes méthyle
autour de la liaison C-C centrale.
2. La conformation la plus stable est la conformation décalée (la plus abondante).
semi-développée
Cram

Ex27 p97
1. La conformation A est la conformation s-trans, et la conformation B est la conformation s-cis.
2. L’axe de rotation pour passer d’une conformation à l’autre est représenté par des pointillés :
3.
Ex32 p99
1.
2.
3.a. Les conformations [a] et [c] sont des conformations éclipsées, [b] et [d] sont des conformations décalées.
b. Les conformations décalées sont plus stables que les conformations éclipsées.
c. Dans la conformation [a], les deux groupes -CH3 terminaux (volumineux) sont très proches : la répulsion électronique
entre ces deux groupes est plus importante que dans la conformation [c].
La conformation [a] est donc moins stable que la conformation [c].
Ex 4 p114
1. (a) et (b) possèdent un carbone asymétrique et forment un couple d'énantiomères.
2. Deux énantiomères sont forcément chiraux, car non superposables à leur image.
Ex5 p115
Les deux couples d’énantiomères sont [a] et [b] d’une part, et [c] et [d] d’autre part.
(les configurations des deux atomes de carbones asymétriques sont différentes)
semi-développée
topologique
Carbone asymétrique

Ex6 p115
1.
2.
3. Il faut changer la configuration du carbone asymétrique.
4. Ces deux structures forment des molécules énantiomères, car elles sont chirales et images l’une de l’autre dans un
miroir.
Ex8 p115
1. Les deux molécules sont images l'une de l'autre dans un miroir. Ce sont donc des énantiomères.
2. Deux énantiomères ont des propriétés chimiques semblables (seules les propriétés biochimiques changent)
Ex12 p116
Les stéréoisomères présentent deux atomes de carbone asymétrique (cf cours IV.2.b)
- Les molécules [b] et [d] sont identiques.
- ([a],[c]) est un couple d'énantiomère (les configurations des deux atomes de carbones asymétriques sont différentes)
- ([a],[b]), ([a],[d]), ([b],[c]), et([c],[d]) sont des couples de diastéréoisomères. (la configuration d'un seul atome de
carbone asymétrique change).
Ex 13 p116
1.
2.
-L’énantiomère de la sertraline (il faut changer les configurations des deux carbones asymétriques)
- Un diastéréoisomère de la sertraline (il faut changer la configuration d'un seul carbone asymétrique)
 6
6
 7
7
 8
8
1
/
8
100%