Activités stéréoisomérie de configuration et de conformation

Stéréoisomérie de configuration et de
conformation
Activité de découverte : importance de la géométrie d’un médicament
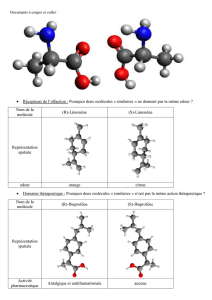
● Document 1 : l’ibuprofène
Il existe deux stéréoisomères de configuration pour l’ibuprofène, principe actif de médicaments
analgésiques : ils diffèrent par la disposition des groupes liés à l’atome de carbone asymétrique
(deux d’entre eux ont été permutés). Un seul de ces stéréoisomères a l’effet thérapeutique
cherché ; il est synthétisé industriellement à raison de 15 000 tonnes par an.
C
O
OH
H
3
CH
C
O
OH
H
CH
3
Stéréoisomères actif (a) et non actif (b) de l’ibuprofène. Ces deux stéréoisomères de
configuration forment un couple d’énantiomères.
●
Document 2 : le propranolol
Le propranolol est le principe actif d’un des
premiers médicaments « bêta-bloquants ».
Sa synthèse a été effectuée dans les
années 1960 par James W. Black, qui a
reçu le prix Nobel de médecine en 1988.
Dans le corps humain, la fixation de
molécules de noradrénaline sur des
récepteurs spécifiques provoque
l’augmentation du rythme cardiaque. Un
médicament bêta-bloquant contient des
molécules telles que le propranolol qui se
substituent à la noradrénaline dans l’étape
de fixation. Il bloque ainsi la transmission
du signal menant à l’augmentation du
rythme cardiaque, et réduit l’hypertension
artérielle.
Les activités biologiques des deux
énantiomères A et B du propranolol ne sont pas les mêmes, l’énantiomère A possède un effet
thérapeutique, alors que B est peu actif. Cette différence s’explique en analysant les interactions
entre le récepteur à noradrénaline et le propranolol.
Lors de la fixation du propranolol sur le récepteur, les acides aminés qui constituent le site actif se
positionnent autour du propranolol pour adopter la conformation la plus stable. Or les interactions
intermoléculaires qui s’établissent entre le stéréoisomère A et le récepteur sont plus nombreuses
que celles qui s’établissent entre B et le récepteur.
Document 1 :
Pour passer d’un stéréoisomère de configuration
à un autre, on est obligé de rompre des liaisons.
C
H
CH
3
Cl
H
O
C
H
CH
3
Cl
H
O
C
H
CH
3
HO
C
l
a
b
C
R
4
H
CH
2
-NH
2
OH Récepteur de
la nodrénaline
Nodrénaline
Fixation de la nodrénaline sur son récepteur,
il en résulte une augmentation du rythme
cardiaque
10
ACTIVITÉS

C NH
2
H
O
H
O
HO
H
Noradrénaline
O C
HO H
N
H
O C
H OH
N
H
Propanolol (énantiomère A) Propanolol (énantiomère B)
Structures de la noradrénaline et des stéréoisomères du propranolol.
Le propranolol est vendu sous forme racémique (un mélange équimolaire des deux énantiomères).
En effet, le dédoublement d’un tel mélange est une opération industrielle complexe, et le
stéréoisomère B n’est pas toxique.
1- Vérifier que les deux structures de l’ibuprofène et du propanolol ne sont pas superposables.
2- Que faudrait-il faire, en utilisant les modèles moléculaires, pour passer d’une forme à l’autre ?
Que signifie alors le terme de stéréoisomérie de configuration.
3- Les structures proposées de l’ibuprofène et de la propanolol sont des énantiomères. Proposer
une méthode pour reconnaitre un couple d’énantiomères.
4- Identifier les similitudes et les différences de structure entre le propranolol et la noradrénaline.
5- Proposer une explication au fait que le stéréoisomère B du propanolol est moins actif
biologiquement.
6- Quel est l’intérêt de vendre le médicament bêta-bloquant sous forme racémique?
7- Conclure l’activité : la géométrie d’une molécule a-t-elle des conséquences sur ses propriétés
biologiques ?
Activité : le scandale du Médiator
● Document 1 : Fenfluramine et dexfenfluramine.
L’isoméride est un médicament coupe-faim qui a été commercialisé dans les années 60. Son
principe actif est la fenfluramine qui contient deux énantiomères (ci-dessous) en quantités égales.
F
3
C
C N
H
H
3
C H
F
3
C
C N
H
H CH
3
Dexfenfluramine
Un premier effet secondaire indésirable de ce médicament a été mis en évidence quelques années
après sa commercialisation : une élévation anormale de la pression sanguine, qui régresse ou
même disparaît avec l’arrêt de la prise du médicament.
Pour pallier ces effets, le médicament fut commercialisé sous forme énantiomérique pure
(Dexfenfluramine seule) à partir de 1985, avant d’être retiré des marchés américain et français en
septembre 1997 les effets secondaires persistaient.
● Document 2 : Métabolisme de la fenfluramine.
Les deux énantiomères de la fenfluramine sont métabolisées
in
vivo
en norfenfluramine : cette molécule serait responsable des
propriétés coupe-faim des médicaments, mais aussi de leurs
effets secondaires indésirables. Mis en évidence en 1995, ce fait
a entraîné leur restriction, puis leur retrait du marché.
F
3
C
NH
2
Norfenfluramine

● Document 3 : Le scandale du Médiator.
En 1976, le benfluorex est mis sur le marché en tant que principe actif du Médiator. In vivo, le
benfluorex est rapidement métabolisé en norfenfluramine. Le Médiator a été retiré du marché en
2009, après le scandale qui a suivi la révélation de ses effets indésirables.
F
3
CH
NO
O
Benfluorex (Mediator)
1- Identifier l’atome de carbone asymétrique de la fenfluramine. Justifier qu’il existe deux formes
chirales.
2- Quelle information indique que le médicament isoméride est un mélange racémique ?
3- En s’appuyant sur les propriétés chimiques de deux énantiomères dans un environnement
chiral, comme le site actif d’un récepteur biologique spécifique, expliquer pourquoi il semblait
justifié de commercialiser la dexfenfluramine seule.
4- À quoi sont dus les effets secondaires indésirables observés chez les personnes ayant
consommé de la fenfluramine ou de la dexfenfluramine ?
5- Pourquoi le Médiator possède-t-il les mêmes effets indésirables que la fenfluramine et la
dexfenfluramine?
6- En quoi l’interdiction tardive du Médiator est-elle étonnante ?
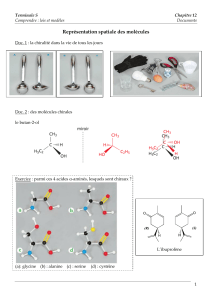
Activité de découverte : comment bien cuire un œuf ?
On dit souvent qu’il faut ajouter une pincée de
sel ou un filet de vinaigre à l’eau de cuisson
d’un œuf pour coaguler le blanc en cas de
fêlure de la coquille.
Le blanc des œufs est essentiellement
constitué d’eau (environ 90 %) et de protéines,
longues molécules biologiques constituées de
longue chaine d’acides α-aminés.
Sous l’effet de différentes interactions entre
ces groupes (forces électrostatiques, liaisons
hydrogène, interactions de van der Waals), les
« fils » acquièrent une structure
tridimensionnelle repliée, sans laquelle la
protéine ne peut remplir sa fonction biologique.
Elles adoptent ainsi une conformation
tridimensionnelle complexe.
Mais quand on chauffe les protéines, l’agitation des molécules augmente et les interactions qui
permettaient leur repliement sont brisées : la protéine est dénaturée. Ces interactions rompues
peuvent être reformées entre protéines voisines. Il se forme alors un réseau de filaments composé
de plusieurs protéines : c’est pourquoi un œuf cuit est opaque.
1- Parmi les acides α-aminés de la figure 1,
quels sont ceux qui peuvent être
responsables :
a- de forces électrostatiques ?
b- de liaisons hydrogène
2- Lors de l’ajout de sel, des ions sodium Na
+
et chlorure Cl
-
sont libérés dans l’eau.
a- Parmi les trois types d’interactions
citées dans le document, quelles sont
celles qui peuvent être perturbées par les ions sodium et chlorure, et donc conduire à la
dénaturation des protéines ?
b- L’ajout de sucre, composé de molécules de saccharose, aurait-il le même effet ? Justifier.
Conformation de deux protéines (a)
dans
l’œuf cru
; (b) dans l’œuf cuit.
Quelques acides α
-
aminés à l’origine des
protéines présentes dans l’œuf
a
b

3- Lors de la cuisson de l’œuf, les liaisons covalentes entre atomes constitutifs d’une protéine
donnée sont-elles modifiées ?
4- Quelle transformation structurale subissent les protéines lors de la cuisson de l’œuf ? Définir
alors le terme de conformation
5- On peut « cuire» suffisamment un œuf en le plongeant dans du vinaigre pendant plusieurs
heures pour le rendre rebondissant. Le vinaigre est une solution acide : quelle espèce
chimique doit-il contenir ? En déduire pourquoi le vinaigre a ici le même effet que le sel.
Activité de découverte : stabilité d’une conformation
Sous l’effet de l’agitation thermique, les groupes d’atomes tournent les uns par rapport aux autres
autour de l’axe des liaisons simples des molécules. A l’aide de l’animation présente sur le site
suivant, http://www.learnerstv.com/animation/animation.php?ani=53&cat=chemistry on peut
visualiser les différentes conformations possibles de l’éthane.
1- Identifier la liaison autour de laquelle une
rotation est effectuée.
2- D’après le diagramme d’énergie, quelle est
la conformation la plus stable : décalée ou
éclipsée ?
3- Comparer la valeur de la « barrière
énergétique » à celle de l’énergie pour
rompre une liaison covalente qui est de
l’ordre de 100 kJ.mol
-1
.
4- En s’appuyant sur les représentations des
conformations éclipsée et décalée, prévoir
le profil énergétique de la molécule de
butane autour de la liaison située entre le
carbone 2 et 3.
Document 3 : Diagramme énergétique et représentation des conformations décalées et
éclipsées pour une rotation de 360° de la liaison C-C pour la molécule d’éthane
Energie de l’éthane p
our différentes
conformations
θ angle de
rotation en
degrés
H
5
H
4
H
6
H
2
H
1
H
3
H
5
H
4
H
6
H
1
H
3
H
2
Ep en
kJ/mol
12
0
0
60
120
180
240
300
360
H
4
H
6
H
5
H
1
H
3
H
2
H
6
H
5
H
4
H
1
H
3
H
2
H
4
H
6
H
5
H
2
H
1
H
3
H
6
H
5
H
4
H
2
H
1
H
3
Observateur
C
H
5
H
4
H
6
C
H
3
H
1
H
2
H
4
H
6
H
5
H
1
H
3
H
2
Document 2 : Projection de Newman pour la
molécule d’éthane

Activité : Conformation la plus stable du propénal
La molécule de propénal CH
2
=CH-CHO peut adopter deux conformations particulières, nommées
conformations s-cis et s-trans. Dans la conformation s-cis, les deux liaisons doubles C=O et C=C
se trouvent du même côté de la liaison simple C-C. Dans la conformation s-trans, ces deux
liaisons doubles sont de part et d’autre de la liaison C-C.
1- En s’aidant des modèles moléculaires ci-dessous, identifier les conformations s-cis et s-trans
du propénal.
Conformation A Conformation B
2- Justifier qu’il est possible de passer de la conformation s-cis à la conformation s-trans par
rotation autour d’une liaison simple C-C. Identifier cet axe de rotation.
3- Donner la formule topologique de ces conformations.
Activité : Quelques molécules présentes dans le vin.
● Document 1 : molécules présentes dans le vin
Le vin contient de nombreuses espèces organiques qui contribuent à ses propriétés gustatives des
alcools, des sucres ou encore des acides. En voici quelques exemples :
O
H
C
H
2
HOOC CH
O
H
COOH
C
H
3
C
C
C
H
3
HO
HOH
H
HO
O
H
OH
● Document 2 : les conformations de l’éthane.
La projection de Newman est une représentation des conformations d’une molécule. Elle
schématise la disposition des atomes selon le point de vue d’un observateur qui regarderait la
molécule dans l’axe d’une liaison C-C. L’atome de carbone au premier plan est représenté par un
point. Le second atome de carbone, à l’arrière, est représenté par un cercle. Les liaisons issues de
ces deux atomes sont projetées dans un plan, comme le montre la figure ci-dessous :
Parmi l’infinité des conformations que peut adopter la molécule d’éthane, la conformation décalée
est la plus stable. La conformation éclipsée, dans laquelle les atomes d’hydrogène sont les plus
proches les uns des autres, est la moins stable. Elle est représentée avec un léger décalage pour
faciliter la lecture.
H
H
H
H
H
H
H
H
H
HH
H
Décalée Eclipsée
Observateur
C
H
5
H
4
H
6
C
H
3
H
1
H
2
H
4
H
6
H
5
H
1
H
3
H
2
Projection de
Newman pour la molécule d’éthane
Le géraniol, qui donne
au vin des arômes de
rose.
l’acide malique dont la
quantité est un indicateur
de l’acidité du vin.
Le butane-2,3-
diol, qui se
forme lors de la
fermentation du glucose.
Le glycérol, qui
contribue à l’onctuosité
du vin.
 6
6
1
/
6
100%