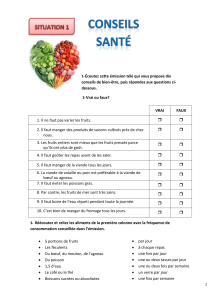
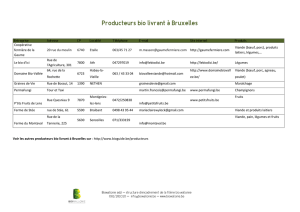
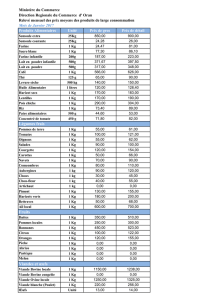
Licence

REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
UNIVERSITE KASDI MERBAH, OUARGLA
FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE
DEPARTEMENT DES SCIENCES BIOLOGIQUE
Projet de Fin d’Etudes
En vue de l’obtention du diplôme de
Licence
Domaine : Sciences de la nature et de la vie
Filière : Biologie
Spécialité : Biochimie fondamentale et appliquée
Thème
Encadreur : Mme Benaissa Atika
M.A. B.
Présenté par :
BENZAOUI Fatima
Examinateur : Mme ABBAS Amel M.A. A.
HOUARI Ahlam
Synthèse bibliographique sur les marqueurs de la
tendreté de la viande
Année universitaire 2013/2014

Remerciements
Avant tous nous remercions Allah tout puissant de nous avoir
accordé la force , le courage et les moyens pour accomplir ce
modeste travail.
Nous tenons à remercier plus particulièrement notre promoteur, qui
nseignante au : M.A.B. e BENAISSA Atika
eme
travail, Ma dirigé ce
Département des Sciences Biologiques à la Faculté des Sciences de la
Nature et de la Vie de l’Université Kasdi Merbah-Ouargla pour son
aide et ses conseils.
Nous tenons à exprimer nos sincères remerciements à tous les
professeurs qui nous ont enseigné et qui par leurs compétences nous
ont soutenu dans la poursuite de nos études.
En fin, c’est avec le plus grand plaisir que nous tenons à exprimer
nos remerciements à tous ceux qui ont contribué de prés ou loin à
la réalisation de ce mémoire.
Merci

Je dédie ce travail :
Aux prunelles des mes yeux, les deux premiers
amours de ma vie : mon père Abdelalwahab et ma mère
Nadjia.
A mes frères et à mes sœurs :
Nedjma, Nadia, Omar, Marwa, Mani, Mohamed,
Oussama, et Arafat.
A mes nièces et neveux. :
Abdelalwahab, Iyad, Abdelalwahab, Assille
-A toutes mes amis,
-A ma tante et voisine
-A tous ceux qui me connaissent de loin ou de prés.
-A tous ceux qui m ‘ont aidé ;
A mes enseignants : Mr Hossein, Mr Daba, Mr Canonna, Mr
Ben chikh et Meme Aboda
B
Be
en
nz
za
ao
ou
ui
i
F
Fa
at
ti
im
ma
a

D
Dé
éd
di
ic
ca
ac
ce
es
s
Ce travail est dédié à :
- les deux premières amours de ma vie :
Mon père Mohamed Saïd
et ma mère Ouahiba
-Mes frères :
Fares, Hamada, Fayez, et Fouad
-ma chère sœur : Soulafa
-A ma tante et voisine
- Touts mes amies
-Mes professeurs
DABBA TOHAMI
Mr.
RGUIBI HOCINE,
Mr.
Surtout:
KADRIN
Mr
et
- A tous les étudiants de la promotion Biochimie 2014.
H
Ho
ou
ua
ar
ri
i
A
Ah
hl
la
am
m

Table des matières
Liste des tableaux
I
Lise des figures
II
Liste des abréviations
III
Introduction
1
-Chapitre I : Transformation du muscle en viande-
Page
I - Transformation du muscle en viande
3
I-1-Définition du muscle
3
I-2-Structure du muscle
3
I-3-Composition chimique
4
I-4-Transformation du muscle en viande
5
I-4-1- Phase de pantelance
5
I-4-2- Rigidité cadavérique ou (rigor mortis)
5
I-4-2-1- Acidification du tissu musculaire
6
I-4-3- Maturation
6
-Chapitre II : Généralités sur la viande-
II- Généralités sur la viande
8
II-1- Viande
8
II-2- Composition biochimique de la viande
8
II-3- Caractéristiques physico-chimiques de la viande
9
II-3-1-Eau
9
II-3-2-Matière minérale
9
II-3-3- Potentiel d’hydrogène
10
-Chapitre III : Qualités organoleptiques de la viande-
III : Qualités organoleptiques de la viande
11
III-1-Définition
11
III-2- Caractéristiques organoleptiques de la viande
11
III-2-1-Couleur
11
III-2-2-Tendreté
12
III-2-3- Flaveur
13
III-2-4-Jutosité
14
-Chapitre IV : Marqueurs de la tendreté-
IV - Marqueurs de la tendreté
15
IV-1- Caractéristiques musculaires reliées à la tendreté
15
IV-1-1- Fibres musculaires
15
IV-1-2- Collagène
17
IV-1-3- Lipides
18
IV-1-4- Systèmes protéolytiques
19
IV-2- Marqueurs de la tendreté
19
IV-2-1- Calpaïnes
20
IV-2-2-Cathepsines
21
IV-2-3-Sous-unité 20S du protéasome
22
IV-2-4- Peptidases à sérine
22
IV-2-5-Matrice Métallopeptidases
23
IV-2-6-Caspases
23
IV-3- Apoptose
23
IV-4- Techniques utilisées pour l’identification de nouveaux marqueurs
24
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
1
/
49
100%