fiche 1

Exercice'
1STD2A''
THÈME':'MONOMÈRES'ET'POLYMÈRE!
'
!
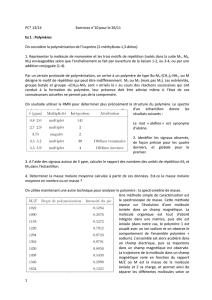
"#!$%!&'()*+),-.%!/012!*3'4+5%.+!&6,!&'()6775+5'.!78!*+),-.%!!!
!
$%!01!*%!&,9+%!+,-*!45%.!68!:'8(6;%!<!'.!%.!=65+!7%!.':4,%8>!'4?%+*!:'8(@*A!;@.@,6(%:%.+!4(6.B*!
/&'+*!7%!)6'8,+2#!
C!D(!*%!&,9+%!45%.!E!(3%>&6.*5'.!/5.*%,+5'.!7%!;6F!76.*!(6!:6+5-,%!=',:6.+!7%*!48((%*!'8!B%((8(%*2A!
'.!'4+5%.+!(%!&'()*+),-.%!%>&6.*@A!68>!G86(5+@*!5*'(6.+%*!/+H%,:5G8%*2!,%:6,G864(%*!/;(6B5-,%*!
&',+6+5I%*2!!
C!+,-*!8+5(5*@!@;6(%:%.+!&'8,!(6!&,'+%B+5'.!B'.+,%!(%*!BH'B*!/%:46((6;%!736&&6,%5(*!=,6;5(%*2.
:!
J#!$%!&(%>5;(6*!/'8!&'():@+6B,)(6+%!7%!:@+H)(%!00KL2!*3'4+5%.+!&6,!&'()6775+5'.!78!:@+6B,)(6+%!7%!
:@+H)(%!!
!
M3%*+!8.!I%,,%!',;6.5G8%!/&(%>5;(6*2! !
N.!(38+5(5*%!%.!'&+5G8%!/I%,,%!7%!(8.%++%*A!(%.+5((%*!7%!B'.+6B+!,5;57%*A!B,5*+6((5.*!6,+5=5B5%(*2#!!
M%,+65.*!B':&'*@*!&'():-,%*!E!46*%!7%!:@+H6B,)(6+%!7%!:@+H)(%!*'.+!8+5(5*@*!B'::%!B5:%.+*!6B,)(5G8%*!
&'8,!',+H'&@75%!%+!'7'.+'(';5%A!&'8,!7%*!&,'+H-*%*!=6B56(%*A!&'8,!(%!B':4(%:%.+!7%!&%,+%*!7%!+5**8*!
'**%8>!%+!7%!+5**8*!&',%8>!
!

!
"# $6!!=',:8(%!–(𝐶!𝐻!!)!−&%,:%+!73%>&,5:%,!(6!:6**%!:'(65,%!:')%..%!!
𝑀!"# =𝑛!"#.(𝑥.𝑀!+2𝑥.𝑀!)!!
𝑀!"# =105000!𝑔.𝑚𝑜𝑙!!!
𝑛!"# =2500!𝑚𝑜𝑡𝑖𝑓𝑠!
𝑀!=12!𝑔.𝑚𝑜𝑙!!!
𝑀!=1,0!𝑔.𝑚𝑜𝑙!!!!
N.!'4+5%.+!7'.B!
105000!=2500(12,0𝑥+2,0𝑥)!!
105000!
2500 =(12,0𝑥+2,0𝑥)!!
*'5+!6&,-*!*5:&(5=5B6+5'.!
42 =12,0𝑥+2,0𝑥!
J# M6(B8(!7%!>!
42 =14,0!𝑥!
𝑥=
42
14,0!!
𝑥=3!
O# $%!&'()&,'&)(-.%!%*+!'4+%.8!&6,!&'():@,5*6+5'.!7%!(36(B-.%!7%!=',:8(%!4,8+%𝐶!𝐻!!!*'5+!𝐶!𝐻!!
$%!:'.':-,%!%*+!8.!6(B-.%!,%.=%,:6.+!O!6+':%*!7%!B6,4'.%!P!5(!*6;5+!78!&,'&-.%!/!&,'&C"C-.%2!
$%!&'()&,'&)(-.%!00!%*+!'4+%.8!&6,!&'()*6775+5'.!78!&,'&-.%!!
!
!
!
"# M6(B8(!7%!(6!:6**%!:'(65,%!:')%..%!78!&'():-,%!!
𝑀!"# =126!.10!𝑔.𝑚𝑜𝑙!!!

(35.75B%!/!7%;,@2!7%!&'():@,5*6+5'.!:')%.!
𝑛=3000!𝑚𝑜𝑡𝑖𝑓𝑠!
$6!:6**%!:'(65,%!:')%..%!!78!&'():-,%!𝑀!"#%+!(6!:6**%!!:'(65,%!78!:'+5=*!𝑀!"#$%!*'.+!(5@*!&6,!
(6!,%(6+5'.!
𝑀!"# =𝑛.𝑀!"#$%!
𝑀!"#$% =!
𝑀!"#
𝑛!
𝑀!"#$% =
126!.10!
3000 =42,0!𝑔.𝑚𝑜𝑙!!!
(%!&'8,B%.+6;%!%.!:6**%!736+':%*!7%!B6,4'.%!%*+!(%!:9:%!76.*!(%!:'+5=!B'::%!76.*!(6!:'(@B8(%!
7%!&'():-,%!
Q.%!:'(%!7%!!:'+5=!,%.=%,:%!7'.B!8.%!:6**%!𝑚!!!
𝑚!=
𝑀!"#$%×85,7
100 !
*'5+!!
𝑚!=
42,0×85,7
100 !
𝑚!=36,0!𝑔.𝑚𝑜𝑙!!!!
$6!B':&'*5+5'.!:6**5G8%!%.!6+':%!7%!B6,4'.%!%*+!7'.B!𝑚!=36,0!𝑔.𝑚𝑜𝑙!!!!!!
R%!:9:%!(6!B':&'*5+5'.!:6**5G8%!%.!6+':%!73H)7,';-.%!%*+!P!
𝑚!=
𝑀!"#$%×(100 −85,7)
100 !
𝑚!=
42,0×(100 −85,7)
100 !
𝑚!=6,0!𝑔.𝑚𝑜𝑙!!!!!
!
J# 15!(%!:'.':-,%!,%.=%,:%!>!6+':%*!7%!B6,4'.%!A!(6!:6**%!736+':%!7%!B6,4'.%!G8%!B'.+5%.+!8.%!
:'(%!7%!:'+5=!%*+!@;6(%!E!P!
𝑚!=𝑥.𝑀!!
𝑚!=𝑥.𝑀!!
!
𝑥=
𝑚!
𝑀!
=
36,0
12,0=3,0!
(%!.':4,%!736+':%*!7%!B6,4'.%!/.@B%**65,%:%.+!8.!.':4,%!%.+5%,2!!
𝑥=3!
$%!:'.':-,%!G85!.%!,%.=%,:%!G8%!78!B6,4'.%!%+!7%!(3H)7,';-.%!,%.=%,:%!68**5!8.%!7'84(%!(565*'.!
B6,!(%!&'():-,%!%*+!'4+%.8!&6,!&'()6775+5'.!!
$%!:'.':-,%!%*+!7'.B!8.!6(B-.%!7%!=',:8(%!4,8+%!;@.@,5G8%!𝐶!𝐻!!!
𝑥=3!
*6!=',:8(%!4,8+%!%*+!7'.B!!
𝐶!𝐻!!
O# 06,:5!(%*!=',:8(%*!&,'&'*@%*!*%8(%!B'.I5%.+!(6!*%B'.7%!B6,!%((%!!,%.=%,:%!8.%!7'84(%!(565*'.!%+!
+,'5*!6+':%!73H)7,';-.%!
S# $6!=',:8(%!78!&'():-,%!%*+!7'.B!!
!
%+!(%!&'():-,%!'4+.8!&6,!&'()6775+5'.!%*+!!(%!&'()&,'&)(-.%!/002!7'.+!!
!
!

!
"# M%!&'():-,%!,@*8(+%!738.%!&'()6775+5'.!738.!6(B-.%!&'**@76.+!8.!6+':%!7%!BH(',%!E!(6!&(6B%!738.!
6+':%!73H)7,';-.%!P!(%!BH(',8,%!7%!I5.)(%!P!!𝐶!𝐻!𝐶𝑙!
!
!
J# K6**%!:'(65,%!78!:'.':-,%!!
𝑀!=2.𝑀!+3.𝑀!+1.𝑀!" =2×12,0+3×1,0+1×35,5!
𝑀!=62,5!𝑔.𝑚𝑜𝑙!!!!
O# D.75B%!7%!&'():@,5*6+5'.!.!
𝑀!!" =75.10!𝑔.𝑚𝑜𝑙!!!
𝑛=
𝑀!!"
𝑀!
!
𝑛=
75.10!
62,5=1,2.10!!𝑚𝑜𝑡𝑖𝑓𝑠!
!
!
"# N.!*65+!G8%!
𝑛=
𝑀!!"
𝑀!
!
𝑀!=
𝑀!!"
𝑛!
𝑀!!" =420.10!𝑔.𝑚𝑜𝑙!!!!
𝑛=10000!!
𝑀!=
420.10!
10000 !
𝑀!=42,0!𝑔.𝑚𝑜𝑙!!!
J# $%!:'.':-,%!,%.=%,:%!8.5G8%:%.+!78!B6,4'.%!%+!7%!(3H)7,';-.%!!*6!=',:8(%!4,8+%!%*+!𝐶!𝐻!!
M%(85!TB5!.36!&8!9+,%!'4+%.8!G8%!&6,!8.%!,@6B+5'.!7%!&'()6775+5'.!5(!,%.=%,:%!7'.B!8.%!7'84(%!
(565*'.!BUB!!
16!=',:8(%!4,8+%!,@&'.7!7'.B!E!𝐶!𝐻!!!

N,!𝑀!=42,0!𝑔.𝑚𝑜𝑙!!!%+!𝑀!=𝑥.𝑀!+2.𝑥.𝑀!!
1'5+!!
42,0=𝑥.𝑀!+2.𝑥.𝑀!!
𝑀!=12,0!𝑔.𝑚𝑜𝑙!!!!
𝑀!=1,0!𝑔.𝑚𝑜𝑙!!!!
42,0=𝑥×12,0+2𝑥×1,0!
42,0=14,0𝑥!
!
𝑥=
42,0
14,0=3!!
16!=',:8(%!4,8+%!%*+!7'.B!E!𝐶!𝐻!!5(!*36;5+!7'.B!78!&,'&-.%/!&,'&C"C-.%2!!
!
!
O# $6!,@6B+5'.!7%!&'():@,5*6+5'.!%*+!8.%!&'()6775+5'.!73@G86+5'.!P!
!
S# $%!&'():-,%!'4+%.8!%*+!78!0'()0,'&)(-.%!7'.+!(364,@I6+5'.!00!B6,!(%!:'+5=!G85!*%!,@&-+%!7@,5I%!78!
;,'8&%!&,'&)(%!/O!6+':%*!7%!B6,4'.%*!(5@*!&6,!(565*'.*!*5:&(%*2!
Q+5(5*@!68**5!&'8,!75==@,%.+*!8*6;%*A!!+5**8!/K@,6V('.2A!B8I%*!736BB8:8(6+%8,*A!,846.*!&'8,!B%,B(%,!
(%*!B'(5*!
!
"# $%!BH(',8,%!7%!I5.)(%!%*+!8.!6(B-.%!,%.=%,:6.+!8.!6+':%!7%!BH(',%!E!(6!&(6B%!738.!6+':%!
73H)7,';-.%!*6!=',:8(%!4,8+%!%*+!𝐶!𝐻!𝐶𝑙!
!
N.!*8&&'*%!G8%!(6!B':48*+5'.!78!BH',8,%!7%!I5.)(%!&,'785+!78!75'>)7%!7%!B6,4'.%!7%!(3%68!%+!78!
BH(',8,%!73H)7,';-.%!!
C!'.!57%.+5=5%!(%*!,@6B+5=*!%+!(%*!&,'785+*!7%!(6!,@6B+5'.!7%!(6!B':48*+5'.!!
𝐶!𝐻!𝐶𝑙 +𝑂!→𝐶𝑂!+𝐻!𝑂+𝐻𝐶𝑙!
8 '.!6?8*+%!(%*!.':4,%*!*+'%BH5':@+,5G8%*!!
𝐶!𝐻!𝐶𝑙 +
5
2𝑂!→2𝐶𝑂!+𝐻!𝑂+𝐻𝐶𝑙!
'8!%.!:8(+5&(56.+!(3%.*%:4(%!7%*!B'%==5B5%.+*!&6,!J!
2𝐶!𝐻!𝐶𝑙 +5𝑂!→4𝐶𝑂!+2𝐻!𝑂+2𝐻𝐶𝑙!
!
J# B':48*+5'.!78!&'()BH(',8,%!7%!I5.)(%!%((%!*%!7@785+!7%!(6!&,@B@7%.+%!%.!B'.*57@,6.+!.!:'+5=*!G85!6!
(6!!:9:%!=',:8(%!4,8+%!G8%!(%!BH(',8,%!7%!I5.)(%!
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%