Polymères : Synthèse et Types - Cours de Chimie

Les polymères
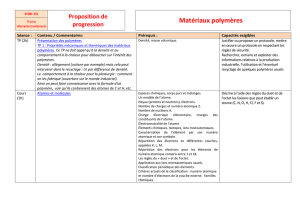
PLAN
Des matériaux organiques
Historique
Les polymères
Synthèse des polymères
Synthèse par réaction de polyaddition
Synthèse par réaction de polycondensation
Remarque: Vous trouverez dans ce document des développements sur les
mécanismes réactionnels qui ne sont pas à traiter avec les élèves.

Les polymères
Ex : Polyéthylène

NOTATION :
Des macromolécules
Ces macromolécules sont formées par exemple de la répétition d’un même motif
n fois tout au long de la molécule

Les polymères, sont des matériaux organiques
composés de macromolécules (molécules géantes).
Ces macromolécules sont formées de la répétition d’un
même motif ou monomère n fois .
nest appelé « degré de polymérisation »
n peut être très élevé : de l’ordre de plusieurs millions
Masse moléculaire molaire M d’un polymère :
M = n x Masse molaire du monomère
M peut être très élevée pour un polymère :
de l’ordre de plusieurs millions de g.mol-1
C’est une moyenne car toutes les chaines n’ont pas la même
longueur exactement

Des matériaux organiques
•Polymères synthétiques
(les « matières plastiques »)
•Polymères naturels
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%