structure des oses simples et dérivés structure des oses simples et

1
STRUCTURE DES OSES SIMPLES ET DÉRIVÉS
STRUCTURE DES OSES SIMPLES ET DÉRIVÉS
1Présentation des oses simples
2Structure linéaire des aldoses
3Structure linéaire des cétoses
4Structure cyclique des aldoses et cétoses
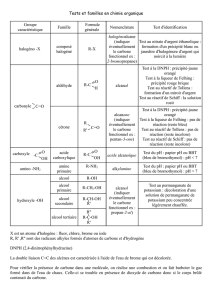
5Les dérivés d’oses simples
Chapitre Quitter
Les oses simples sont des molécules constituées d’une chaîne carbonée
de 3 à 9 éléments carbone. Les oses principalement impliqués dans les
voies métaboliques sont des oses constitués de 3 à 6 éléments
carbones.
Chaque molécule à n éléments carbone contient un groupement
carbonyle et n-1 groupements hydroxyles.
Suivant l’emplacement du groupement carbonyle sur la chaîne
carbonée on observera une fonction aldéhyde ou une fonction cétone.
Dans le premier cas les molécules seront appelées des aldoses, dans le
second cas, des cétoses.

2
pour 3 carbones, on parlera de trioses
pour 4 carbones, on parlera de tétroses
pour 5 carbones, on parlera de pentoses
pour 6 carbones, on parlera d’hexoses
pour 7 carbones, on parlera d’heptoses
pour 8 carbones, on parlera d’octoses
pour 9 carbones, on parlera de nanoses
Les oses seront également désignés en tenant compte de leur
nombre d’éléments carbone :
Le carbone portant le groupement carbonyle a toujours le numéro le plus
petit, à savoir :
N°1 pour les aldoses
N°2 pour les cétoses
NUMÉROTATION DES OSES SIMPLES
NUMÉROTATION DES OSES SIMPLES

3
C
HO
OH
OH
OH
HO
CH2OH
D- Glucose
1
6
5
4
3
2
EXEMPLE D’UTILISATION DE LA NOMENCLATURE
EXEMPLE D’UTILISATION DE LA NOMENCLATURE
Le glucose est constitué d’une chaîne
de 6 éléments carbone ainsi que d’une
fonction aldéhyde.
On dira qu’il s’agit d’un aldohexose
H
H
H
H
CH2OH
O
OH
OH
CH2OH
D- Ribulose
1
5
4
3
2
Le ribulose est constitué d’une chaîne
de 5 éléments carbone ainsi que d’une
fonction cétone.
On dira qu’il s’agit d’un cétopentose
H
H
EXEMPLE D’UTILISATION DE LA NOMENCLATURE
EXEMPLE D’UTILISATION DE LA NOMENCLATURE

4
C
C
C
C
C
C
HO
C
C
HO
OH
CH2OH
Ce carbone est asymétrique
il y a donc 2 configurations possibles
1
3
2H
CONSTRUCTION DE L’ALDOSE LE PLUS SIMPLE
CONSTRUCTION DE L’ALDOSE LE PLUS SIMPLE
Sur la base des critères présentés dans la présentation générale,
l’aldose le plus simple sera un aldotriose avec une fonction
aldéhyde et deux groupements hydroxyles :
*
C
C
HO
OH
CH2OH
D-glycéraldéhyde L-glycéraldéhyde
H
Il existe deux aldotrioses qui ne diffèrent que par la configuration de leur
carbone asymétrique.
C
C
HO
HO
CH2OH
H
**
La représentation utilisée ici correspond à la représentation de Fischer
Le composé D est dextrogyre, le composé L est lévogyre.

5
A partir du D-glycéraldéhyde,
on définit la série D des aldoses
A partir du L-glycéraldéhyde,
on définit la série L des aldoses
Les oses naturels sont essentiellement de la série D
OH à droite = série D OH à gauche = série L
C
C
HO
OH
CH2OH
D-glycéraldéhyde L-glycéraldéhyde
H
C
C
HO
HO
CH2OH
H
**
REPRÉSENTATION DE FISCHER ET SÉRIE DES COMPOSÉS
REPRÉSENTATION DE FISCHER ET SÉRIE DES COMPOSÉS
En représentation de Fischer, la série est définie par la position du
groupement hydroxyle placé sur le carbone asymétrique ayant le numéro
le plus élevé
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%