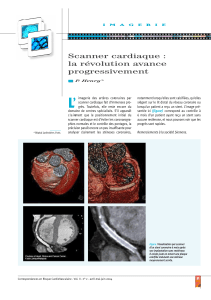
Que répondre à un fumeur qui demande un scanner du

“DOCTEUR, JE SUIS FUMEUR ET J’AI PEUR DU CANCER.
PUIS-JE BÉNÉFICIER D’UNE RADIOGRAPHIE DU THORAX
OU D’UN SCANNER ?”
Cette question revient de plus en plus souvent. Doit-on accepter ?
Doit-on refuser cette demande ?
L’Organisation mondiale de la santé (OMS) a défini des règles pour
affirmer qu’une maladie justifie un dépistage :
1. La maladie concernée est fréquente et crée un problème de santé
(à l’échelle de la population et/ou à celle de l’individu).
2. Le dépistage à un stade précoce apporte un bénéfice pour le sujet
atteint (amélioration de la survie, ou de l’état physique, ou de la
qualité de vie).
3. La société peut assurer la prise en charge du dépistage et le trai-
tement des individus dépistés.
4.Les autres méthodes diagnostiques ne sont pas applicables ou
entraînent un retard diagnostique préjudiciable au malade.
5. Il existe un test de dépistage fiable, sensible, spécifique, peu coû-
teux et non invasif applicable à la population concernée.
Il existe des raisons théoriques solides de penser qu’un dépistage
précoce est susceptible d’améliorer le pronostic du cancer bron-
chique. C’est le cancer le plus meurtrier chez l’homme. En progres-
sion constante chez la femme, son incidence a triplé au cours des
vingt dernières années. La survie à 5 ans n’est que de 15 %. Les
symptômes ne sont pas spécifiques. Ils apparaissent à un stade
souvent avancé et, dans 80 % des cas, il existe déjà des métastases.
Or, dans les séries chirurgicales, 80 % des tumeurs T1 N0 (tumeurs
de moins de 3 cm de diamètre sans ganglion envahi) peuvent être
guéries par résection chirurgicale. Mais les séries rétrospec-
tives chirurgicales ne sont pas des séries de tumeurs issues du
dépistage.
QUE PENSER DE LA RADIOGRAPHIE DU THORAX
COMME MOYEN DE DÉPISTAGE DU CANCER ?
Dans les années 1970, le dépistage du cancer bronchique par la
radiographie pulmonaire et/ou par la cytologie de l’expectoration
a été évalué par quatre grandes études randomisées comportant
chacune 10 000 sujets. Trois études étaient nord-américaines et
une étude était européenne (1-7). Ces quatre études n’ont pas per-
mis de montrer un gain sur la mortalité liée spécifiquement au
cancer bronchique. Ces études ont fait l’objet d’intenses contro-
verses, d’autant que la qualité des radiographies s’est considéra-
blement améliorée depuis 20 ans. C’est pourquoi le National Can-
cer Institute a inclus dans son programme Prostate, Lung,
Colorectal, Ovarian (PLCO) une réévaluation de la radiographie
du thorax (8). Les résultats ne sont pas encore publiés.
LE SCANNER EST-IL PLUS PERFORMANT
QUE LA RADIOGRAPHIE DU THORAX
POUR DÉPISTER DES PETITES TUMEURS ?
Les progrès du scanner permettent une meilleure détection et une
meilleure caractérisation des nodules pulmonaires grâce à la possi-
bilité qu’offrent les nouveaux appareils de réaliser un échantillon-
nage de l’ensemble du volume pulmonaire au cours d’une simple
inspiration profonde. Le balayage hélicoïdal et, plus récemment,
les scanners à multidétecteur, représentent des avancées technolo-
giques essentielles qui ont permis de progresser dans l’exploration
du parenchyme pulmonaire. Il est ainsi possible de détecter des
nodules de l’ordre de 2 à 3 mm, alors que la radiographie thora-
cique n’est performante qu’à partir de 20 mm. Ces progrès dans la
détection permettent aussi d’abaisser la dose de rayons X néces-
saire. Un examen de dépistage, en basse dose, correspond à l’irra-
diation d’environ 10 clichés thoraciques.
Le scanner a aujourd’hui une sensibilité très élevée, mais une spé-
cificité faible. Hormis les cas où les nodules ont des aspects permet-
tant d’affirmer leur bénignité (calcifications massives, association
de graisse et de calcifications) ou leur malignité (contours spiculés),
les deux seules façons de juger de la nature d’un nodule sont sa taille
et son évolution.
Aucun pays, en dehors du Japon, n’a institué de dépistage systé-
matique par scanner thoracique à grande échelle. Aux États-Unis,
le National Lung Screening Trial (NLST) a initié, en novembre
2002, un essai incluant 50 000 sujets, fumeurs ou ex-fumeurs,
randomisés en deux groupes, l’un bénéficiant d’un scanner héli-
coïdal annuel durant trois années consécutives et l’autre bénéficiant
d’une radiographie thoracique. Cet essai a pour objectif de déter-
miner si le scanner est susceptible de diminuer la mortalité spéci-
fique liée au cancer bronchique. Les résultats ne seront pas connus
avant 8 à 10 ans.
Que répondre à un fumeur qui demande
un scanner du thorax ?
●
E. Lemarié
* Service de pneumologie, INSERM U 618, IFR 135, hôpital Bretonneau, CHU
de Tours.
EN UNE RÉFÉRENCE
16
La Lettre du Pneumologue - Volume IX - no1 - janvier-février 2006

SI AUCUNE ÉTUDE RANDOMISÉE N’A ÉTÉ PUBLIÉE, EXISTE-T-IL
DES ÉTUDES PILOTES QUI ONT MONTRÉ L’INTÉRÊT DU
SCANNER POUR LA DÉTECTION DU CANCER BRONCHIQUE ?
Plusieurs études de cohortes, sans groupe contrôle, ont permis
d’évaluer le scanner à faible dose.
●
●Les Japonais ont, les premiers, montré la grande sensibilité du
scanner, capable de détecter des cancers à des stades précoces, dont
le diamètre moyen est inférieur à 20 mm. Trois grandes séries japo-
naises (9-11) ont inclus des hommes et des femmes de plus de
40 ans, fumeurs et non fumeurs. Sur un total de 15 050 scanners
initiaux, 6,6 % montraient des anomalies, parmi lesquelles 71 can-
cers furent identifiés. Dans ces trois études, la prévalence du cancer
bronchique allait de 0,4 % à 0,8 % et son incidence de 0,1 % à
0,6 %. Le taux de stades I était de 77 à 100 %.
●
●L’étude Early Lung Cancer Action Program (ELCAP) a inclus
1000 sujets volontaires, âgés d’au moins 60 ans, fumeurs ou anciens
fumeurs consommant au moins 10 paquets-année. Ils ont bénéficié
d’une radiographie pulmonaire et d’un scanner hélicoïdal à faible
dose. Lors du scanner initial, 1 à 6 nodules pulmonaires non calcifiés
ont été détectés chez 233 sujets. Seuls 33 nodules avaient été détec-
tés par la radiographie. Le diagnostic de cancer a été retenu chez
27 sujets, dont 23 cancers de stade I et 26 cancers résécables, soit
une prévalence du cancer bronchique de 2,7 % par scanner, contre
0,7 % par la radiographie (12). Après un an de suivi, des nodules
pulmonaires non calcifiés ont été détectés chez 4 % des sujets inclus,
dont 1,1 % de nodules malins et 1 % de cancers de stade Ia (13).
●
●Le New Mayo Lung Project a été mis en place en 1999 pour
évaluer le dépistage du cancer par le scanner à faible dose et par
la cytologie de l’expectoration (14). Il s’agissait de femmes et
d’hommes ayant un passé tabagique d’au moins 20 paquets-année
(61 % de fumeurs et 39 % d’anciens fumeurs). Un an après, au moins
un nodule pulmonaire non calcifié de plus de 3 mm de diamètre était
détecté chez 51 % des 1 520 sujets inclus dans l’étude (785 hommes
et 735 femmes, âgés de plus de 50 ans). Le nombre plus important
de nodules détectés s’explique par le caractère plus récent de cette
étude, utilisant des scanners à multidétecteur. Il s’agissait d’un can-
cer chez 1,8 % des personnes incluses. Nous disposons des résul-
tats à 5 ans (15). Les scanners répétés ont été pratiqués chez 98 % des
sujets à un an, chez 96 % à 2 ans, chez 95 % à 3 ans et chez 819 sujets
à 4 ans. Au total, 3 356 nodules ont été découverts : 61 % étaient de
moins de 4 mm, 34 % de 4 à 7 mm et 5 % de 8 à 20 mm. Soixante-
trois cancers bronchiques ont été découverts chez 63 sujets :
30 cancers prévalents, 30 cancers incidents et 3 cancers apparus
dans l’intervalle. Le scanner a découvert 60 cancers et l’examen
cytologique de l’expectoration, 3 cancers. Soixante-huit pour cent
des cancers prévalents et 71 % des cancers incidents étaient des
carcinomes non à petites cellules de stade I. Cinquante-trois résec-
tions ont été pratiquées. Douze patients ont été opérés pour des
tumeurs bénignes.
●
●En Allemagne, les résultats de Diederich et al. sont similaires
à ceux du Mayo Lung Project (16). Sur les 817 sujets inclus, fumeurs
de plus de 20 paquets-année, 43 % avaient des nodules sur le
scanner initial. Parmi ceux-ci, 29 sujets ont eu une biopsie d’un
nodule : 10 cancers ont été diagnostiqués, auxquels il faut ajou-
ter un cancer diagnostiqué dans l’intervalle.
Au total, ces études pilotes montrent que le scanner thoracique est
capable de détecter des tumeurs bronchiques de façon précoce.
Elles ne permettent pas de démontrer que le scanner thoracique est
susceptible de diminuer la mortalité spécifique par cancer bron-
chique. Seules des études randomisées permettront de le faire.
Une autre conclusion importante de ces études concerne la relation
entre la taille des nodules et l’incidence des cancers : parmi les
nodules de moins de 5 mm, il n’existe pratiquement pas de cancer.
Ils ne justifient pas de suivi.
En France, le programme DEPISCAN, né d’une collaboration entre
l’Institut national de la santé et de la recherche médicale (Inserm),
la Société française de radiologie (SFR) et la Société de pneumo-
logie de langue française (SPLF), est une phase pilote construite
sur un modèle similaire à celui du NLST. Son objectif principal
était de tester la faisabilité d’une possible étude randomisée (scan-
ner versus radiographie thoracique) auprès de 1 000 fumeurs ou
ex-fumeurs de plus de 50 ans suivis pendant deux ans. Le recru-
tement des sujets a été assuré par 130 médecins généralistes auprès
de 14 centres hospitaliers universitaires et généraux, ainsi que dans
des centres privés, répartis sur le territoire français. L’évaluation
concernait les aspects relatifs à la sécurité des patients, à l’impact
du dépistage sur leur qualité de vie et sur leur consommation de
tabac, ainsi que les aspects médico-économiques. En mars 2005,
784 sujets étaient randomisés, et 526 formulaires de radiologie
avaient été saisis. Il s’agissait d’une population de gros fumeurs,
consommant en moyenne plus de 30 paquets-année. Dans le bras
scanner, 49,8 % des sujets avaient des nodules. Le taux de cancers
dépistés n’est pas encore connu.
A-T-ON ÉVALUÉ LE RAPPORT BÉNÉFICE/RISQUE
DU DÉPISTAGE DU CANCER BRONCHIQUE PAR LE SCANNER ?
Le rapport bénéfice/risque du dépistage du cancer bronchique par
le scanner n’a jamais été évalué, sauf sous la forme de modèles
mathématiques (17-19). Les anomalies détectées sont fréquentes
et engendrent des examens complémentaires invasifs (endoscopie
bronchique, ponction transthoracique, résection chirurgicale des
nodules) afin de préciser le diagnostic. Ces examens peuvent être
à l’origine de complications. En outre, ils peuvent provoquer de
l’angoisse chez le patient. Il faut donc être prudent avant de pres-
crire un scanner, dont l’intérêt n’est pas démontré en matière de
diminution de mortalité spécifique par cancer bronchique.
“J’AI COMPRIS QUE LE SCANNER N’ÉTAIT PAS UN EXAMEN
QUI PERMETTAIT DE MODIFIER INDISCUTABLEMENT
MON PRONOSTIC SI L’ON DÉCOUVRAIT UN CANCER.
MAIS, SI JE SUBIS UN SCANNER, PEUT-ÊTRE VAIS-JE
DIMINUER MA CONSOMMATION DE TABAC ?”
Pour répondre, il faudrait connaître l’impact d’un programme de
dépistage par scanner thoracique sur le tabagisme. Nous n’avons
pas de réponse claire à cette question, d’autant que cet impact
devrait varier d’un pays à l’autre en fonction du contexte culturel.
Les seules données dont nous disposons sont celles du Mayo Lung
Project (20) : le programme de dépistage associé à une aide au
17
La Lettre du Pneumologue - Volume IX - no1 - janvier-février 2006

EN UNE RÉFÉRENCE
18
La Lettre du Pneumologue - Volume IX - no1 - janvier-février 2006
sevrage favorise l’arrêt chez tous les participants. L’arrêt est deux
fois plus élevé chez les sujets chez qui sont découverts des nodules
pulmonaires. Les questionnaires patients de l’étude DEPISCAN
permettront de répondre pour la France à cette question.
“SI L’ON ME TROUVE UN NODULE PULMONAIRE,
QU’ALLEZ-VOUS FAIRE ?”
La SPLF et la SFR ont élaboré un arbre décisionnel fondé sur la
taille du nodule (figure).
Au total, nous n’avons aucune justification à ce jour pour prescrire
un scanner thoracique.
J.L. Mulshine et D.C. Sullivan résument ces données dans un
article récent (21).
POUR EN SAVOIR PLUS…
1.Frost J, Ball WC, Levin M et al. Early lung cancer detection: results of the
initial (prevalence) radiologic and cytologic screening in the Johns Hopkins
Study. Am Rev Respir Dis 1984;130:549-54.
2.Tockman MS. Lung cancer screening: the Johns Hopkins study. Chest 1986;
89(suppl):324-34.
3.Melamed MR. Lung cancer screening results in the National Cancer Institute
New York Study. Cancer 2000;89:2356-62.
4.Fontana R, Sanderson DR, Woolner LB et al. Lung cancer screening: the
Mayo program. J Occup Med 1986;28:746-50.
5.Marcus PM, Bergstralh EJ, Fagerstrom RM et al. Lung cancer mortality in
the Mayo Lung Project: impact of extended follow-up. J Natl Cancer Inst
2000;92:1308-16.
6. Kubik A, Polak J. Lung cancer detection: results of a randomized prospective
study in Czechoslovakia. Cancer 1986;57:2427-37.
7.Kubik AK, Parkin DM, Zatloukal P. Czech study on lung cancer screening:
post-trial follow-up of lung cancer deaths up to year 15 since enrollment. Cancer
2000;89:2363-8.
8.Gohagan J, Prorok PC, Hayes RB et al. The Prostate, Lung, Colorectal, and
Ovarian Cancer Screening Trial of the National Cancer Institute: history,
organization, and status. Control Clin Trial 2000;21:251S-72S.
9.Sobue T, Moriyama N, Kaneko M et al. Screening for lung cancer with low-
dose helical computed tomography: anti-lung cancer association project.
JClin Oncol 2002;20:911-20.
10. Sone S, Li F, Yang ZG et al. Results of three-year mass screening pro-
gramme for lung cancer using mobile low-dose spiral computed tomography
scanner. Br J Cancer 2001;84:25-32.
11. Nawa T, Nakagawa T, Kusano S, Kawasaki Y, Sugawara Y, Nakata H.
Lung cancer screening using low-dose spiral CT: results of baseline and 1-year
follow-up studies. Chest 2002;122:15-20.
12. Henschke CI, Mccauley DI, Yankelevitz DF et al. Early lung cancer action
project: overall design and findings from baseline screening. Lancet 1999;
354:99-105.
13. Henschke CI, Naidich DP, Yankelevitz DF et al. Early lung cancer action
project: initial findings on repeat screenings. Cancer 2001;92:153-9.
14. Swenson SJ, Jett JR, Sloan JA et al. Screening for lung cancer with low-dose
spiral computed tomography. Am J Respir Crit Care Med 2002;165:433-4.
15. Jett JR, Swensen SJ, Midthun DE et al. Screening for lung cancer with low-
dose spiral computed tomography (SCT): The Mayo Clinic Trial. Am J Respir
Crit Care Med 2004;169:A752.
16. Diederich S, Wormanns D, Semik M et al. Screening for early lung cancer
with low-dose spiral CT: prevalence in 817 asymptomatic smokers. Radiology
2002;222:773-81.
17. Marshall D, Simpson KN, Earle CC et al. Potential cost-effectiveness of
one-time screening for lung cancer (LC) in a high risk cohort. Lung Cancer
2001;32:227-36.
18. Marshall D, Simpson KN, Earle CC et al. Economic decision analysis
model of screening for lung cancer. Eur J Cancer 2001;37:1759-67.
19. Miettinen OS. Screening for lung cancer: can it be cost-effective? Can
Med Assoc J 2000;162:1431-6.
20. Cox LS, Clark MM, Jett JR et al. Change in smoking status after spiral
chest computed tomography scan screening. Cancer 2003;98:2495-501.
21. Mulshine JL, Sullivan DC. New developments in lung cancer screening.
NEngl J Med 2005;352;26:2714-20.
Les points essentiels (d’après Mulshine et Sullivan)
●
●Aucune donnée n’est disponible actuellement à partir d’études
randomisées. Les premiers résultats ne seront connus que dans
4 à 5 ans.
●
●Les résultats issus d’études pilotes chez des sujets à haut
risque indiquent un taux élevé de cancers de stade I.
●
●Le scanner de dépistage révèle un nombre élevé de nodules
non calcifiés. Une petite fraction correspond à un cancer.
●
●Les procédures nécessaires pour aboutir au diagnostic de ces
nodules sont coûteuses et à risque de complications.
●
●La prise en charge de ces nodules nécessite une concertation
multidisciplinaire.
●
●Le meilleur moyen de diminuer le risque de cancer est le
sevrage tabagique.
●
●Après résection d’un cancer, il y a un fort risque de récidive,
d’où la nécessité d’une surveillance.
Figure 1. DEPISCAN : arbre décisionnel SPLF-SFR de prise en charge
des nodules constatés au scanner.
Nodules au scanner initial
Nodule
bénin < 5 mm ≥ 5 et < 10 mm ≥ 10 mm
Pas de
surveillance
particulière
Scanner
à 3 mois
ou TEP
si nodule
> 7 mm
a. Si grossit :
biopsie
b. Si stable :
scanner à 6
et 12 mois
Dossier discuté en réunion
multidisciplinaire
À titre indicatif : scanner
à 1 mois (après cure
antibiotique si verre dépoli)
ou TEP d’emblée
a. Si disparition :
aucune surveillance
b. Si grossit : biopsie
c. Si stable : TEP et/ou
scanner à 3 et 6 mois
et/ou ponction
1
/
3
100%