humaine: Androgénisation rôle d`une enzyme clé - iPubli

SYNTHÈSE
Pierre Mauvais-Jarvis,
Frédérique Kuttenn,
Irène Mowszowicz,
Françoise Wright
Service d'endocrinologie de la
reproduction, hôpital Necker
149,
humaine:
Androgénisation
rôle d'une enzyme clé
A
à
à
à
à
·

à
à
à
à
à
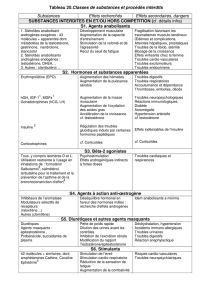
Le modèle .
des trois enzymes
à

i
témoins
!


Summary
1
/
5
100%