Modification de la fonction thyroïdienne par les inhibiteurs de

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 7 - septembre 2011
234
dossier thématique
d
d
d
d
d
d
d
d
d
d
d
d
d
d
d
o
o
o
o
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
i
i
e
e
e
e
r
r
r
t
t
t
t
h
h
h
h
h
é
é
é
é
é
é
é
é
é
m
m
m
m
m
m
a
a
a
tt
t
t
t
i
i
i
i
q
q
q
q
q
u
u
u
u
u
e
e
e
Endocrinopathies
induites par les traitements
anticancéreux
Modification de la fonction
thyroïdienne par les inhibiteurs
de tyrosine kinases
Tyrosine kinase inhibitors and thyroid function tests
Frédéric Illouz*
,
**, Sandrine Laboureau-Soares*, Ingrid Allix*, Patrice Rodien*
,
**
,
***
Points forts
Highlights
»
Les inhibiteurs de tyrosine kinases (ITK) modifient la fonction
thyroïdienne en entraînant une hypo- ou une hyperthyroïdie.
»
Les mécanismes physiopathologiques sont encore incertains
et varient selon les molécules : par exemple, thyroïdite
destructive (avec le sunitinib), modification du métabolisme
de la lévothyroxine (avec l’imatinib).
»
L’évaluation préthérapeutique de la fonction thyroïdienne est
indispensable et doit être poursuivie régulièrement pendant
le traitement.
»
La diffusion des ITK nécessite de la part des oncologues une
connaissance de leurs effets thyroïdiens.
Mots-clés : Inhibiteurs de tyrosine kinases – Thérapie ciblée
– Hypothyroïdie – Hyperthyroïdie.
Tyrosine kinase inhibitors (TKI) can alter the thyroid function
leading to hypothyroidism or hyperthyroidism.
Physiopathological mechanisms remain unknown and
depend on the molecules: for example, destructive thyroiditis
(by sunitinib) modification of the metabolism of levothyroxine
(by imatinib).
Pretherapeutic tests of the thyroid function are necessary and
have to be taken regularly during treatment.
As TKI are largely used, oncologist must be aware of their
thyroid effects.
Keywords : Tyrosine kinase inhibitors – Targeted therapy
– Hypothyroidism – Hyperthyroidism.
* Département d’endocri-
nologie – diabétologie –
nutrition, CHU d’Angers.
** Centre de référence
des pathologies
de la réceptivité
hormonale, CHU d’Angers.
*** Inserm, U771,
Angers.
L
es tyrosine kinases (TK) sont des protéines
enzymatiques qui catalysent le transfert d’un
phosphate de l’adénosine triphosphate (ATP)
sur le résidu tyrosine d’une protéine. Ces TK sont sou-
vent des récepteurs – comme les récepteurs du VEGF
(VEGFR) ou du PDGF (PDGFR) – ou des facteurs de crois-
sance. Certaines TK sont impliquées dans l’initiation
de l’oncogenèse thyroïdienne (le récepteur RET dans
le carcinome médullaire ou la protéine BRAF dans les
carcinomes papillaires) et d’autres sont nécessaires aux
événements secondaires de l’oncogenèse, comme les
VEGFR dans l’angiogenèse. Une revue récente décrit
parfaitement les différents mécanismes liant les TK
au processus d’oncogenèse (1). Quels que soient les
mécanismes impliqués, l’activation excessive des TK
peut provoquer une prolifération, une survie et une
invasivité cellulaires anormales, ainsi qu’un défaut de
régulation de l’angiogenèse tumorale.
Les inhibiteurs de tyrosine kinases (ITK) appartiennent
aux nouvelles thérapies moléculaires : ils ciblent une ou
plusieurs TK ou leurs voies de signalisation impliquées
directement dans l’oncogenèse (RET, BRAF) [2]. Mais
les ITK ne sont pas spécifiques d’une seule TK et la
plupart d’entre eux gardent des propriétés antiangio-
géniques en interagissant avec les VEGFR ou les PDGFR
(2). La grande majorité des effets hormonaux de ces
molécules concerne les modifications de la fonction
thyroïdienne.
Cet article aborde une à une les molécules impliquées
à ce jour dans les dysfonctions thyroïdiennes, en envi-
sageant par ailleurs leurs mécanismes physiopatho-
logiques.
Sunitinib (Sutent
®
)
Données cliniques
Le sunitinib cible les VEGFR, le PDGFR et les récep-
teurs KIT et RET, qui sont impliqués dans la croissance
tumorale, dans l’angiogenèse et dans le potentiel

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 7 - septembre 2011
235
Modification de la fonction thyroïdienne par les inhibiteurs de tyrosine kinases
métastatique (2). Initialement, le traitement par sunitinib
se composait de cycles de 6 semaines correspondant à
une période de 4 semaines avec traitement (période on),
suivie de 2 semaines sans traitement (période off) ;
actuellement, ce traitement est proposé en continu
à plus faible dose. Le tableau résume les principales
publications qui ont analysé les effets du sunitinib sur
la fonction thyroïdienne. En 2006 et pour la première
fois, Desai et al., analysant 42 sujets traités par sunitinib
pour une tumeur stromale gastro-intestinale (GIST),
objectivent l’apparition d’une TSH anormale chez 62 %
d’entre eux, dont 36 % avaient une hypothyroïdie per-
sistante (TSH > 7 mUI/l) nécessitant une substitution
(3), et 17 % avaient une TSH entre 5 et 7 mUI/l. Depuis,
différentes études ont analysé le risque d’hypothyroïdie
sous sunitinib, estimé entre 7 et 85 % (4-9). Mannavola
et al. rapportent une hypothyroïdie persistante chez
46 % des patients (4). De plus, 25 % d’entre eux ont une
élévation transitoire de la TSH (4). Dans une étude de
phase I/II sur la cardiotoxicité du sunitinib dans le cadre
d’un traitement pour une GIST, Chu et al. décrivent une
élévation de la TSH chez 14 % des patients, après une
durée moyenne de traitement de 54 mois (6). Dans
l’étude de Rini et al., des anomalies compatibles avec
une hypothyroïdie (TSH élevée, T4 libre ou T3 libre abais-
sée) sont retrouvées chez 85 % des 66 sujets traités
pour cancer du rein (7). L’étude de Wolter et al. vient
préciser le risque d’hypothyroïdie, en analysant de façon
prospective les modifications de la fonction thyroï-
dienne en début et en fin de période on de traitement
(8). Une élévation permanente ou transitoire de la TSH
apparaît chez 66 % des sujets, et un traitement par lévo-
thyroxine est institué pour 27 % d’entre eux. Dans une
étude récente portant sur l’efficacité du sunitinib dans
le traitement des tumeurs endocrines pancréatiques,
7 % des patients ont développé une hypothyroïdie sans
que l’on connaisse leur statut thyroïdien antérieur (9).
Cette fréquence, qui semble moins élevée que dans
les autres séries, peut être expliquée par le schéma
thérapeutique à moindre dose et en continu.
Le retentissement clinique de l’hypothyroïdie est difficile
à apprécier, car ses symptômes sont peu spécifiques et
fréquents chez les sujets atteints de cancer. Les deux
études sur l’hypothyroïdie montrent que la plupart
des patients sont symptomatiques, la substitution
hormonale réduisant les symptômes chez la moitié
d’entre eux (7, 8).
Le risque d’hypothyroïdie semble s’accroître avec le
temps, et donc avec le nombre de cycles de traite-
ment. Dans toutes les séries, la TSH s’élève en fin de
période on et se rapproche de la normale en fin de
période off, créant ainsi une hypothyroïdie transitoire.
5BCMFBV Fréquence de l’hypothyroïdie ou adaptation thérapeutique de la lévothyroxine sous inhibiteurs de tyrosine kinases.
Molécules Sujets (n) Indications Hypothyroïdie ou adaptation thérapeutique (%)
Desai, 2006 (3) Sunitinib 42 GIST 36
Mannavola, 2007 (4) Sunitinib 24 GIST 71
Wong, 2007 (5) Sunitinib 40 Tumeurs solides (surtout GIST) 53
Chu, 2007 (6) Sunitinib 36 GIST 14
Rini, 2007 (7) Sunitinib 66 CR 85
Wolter, 2008 (8) Sunitinib 59 CR, GIST 61
Raymond, 2011 (9) Sunitinib 86 TE pancréatique 7
De Groot, 2005 (16) Imatinib 11 CMT, GIST 100 chez les sujets thyroïdectomisés
De Groot, 2007 (17) Imatinib 15 CMT 100 chez les sujets thyroïdectomisés
Sherman, 2008 (20) Motesanib 93 CDT 22
Tamaskar, 2007 (24) Sorafénib 39 CR 18
Gupta-Abramson, 2008 (25) Sorafénib 33 CDT Adaptation thérapeutique chez 30
Hoftijzer, 2009 (26) Sorafénib 31 CDT Majoration en L-T4 chez 19
Réduction en L-T4 chez 16
Robinson, 2010 (33) Vandetanib 19 CMT Élévation de la TSH
Majoration en L-T4 chez 10
Kim, 2010 (35) Nilotinib
Dasatinib
55
10
LMC
LMC
22
50
GIST : tumeur stromale gastro-intestinale ; CR : cancer du rein ; TE : tumeur endocrine ; CMT : carcinome médullaire thyroïdien ; CDT : cancer différencié thyroïdien ; LMC : leucémie myéloïde chronique.

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 7 - septembre 2011
236
dossier thématique
d
d
d
d
d
d
d
d
d
d
d
d
d
d
d
o
o
o
o
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
i
i
e
e
e
e
r
r
r
t
t
t
t
h
h
h
h
h
é
é
é
é
é
é
é
é
é
m
m
m
m
m
m
a
a
a
tt
t
t
t
i
i
i
i
q
q
q
q
q
u
u
u
u
u
e
e
e
Endocrinopathies
induites par les traitements
anticancéreux
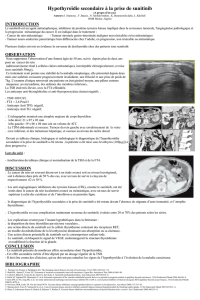
Cependant, avec la répétition des cycles, la TSH a ten-
dance à rester élevée en fin de période off, menant ainsi
à une hypothyroïdie permanente (3, 4, 8). La figure 1
illustre parfaitement les variations de niveau de la TSH
lors du traitement par sunitinib (Dr Damatte-Fauchery,
données personnelles). Les études analysant la fonction
thyroïdienne après l’arrêt du sunitinib restent contra-
dictoires quant à la persistance ou non de l’hypo-
thyroïdie (3, 4).
Un effet vasculaire prédominant
La première hypothèse physiopathologique est celle
d’une thyroïdite destructrice : Desai et al. retrouvent une
évolution biphasique de la fonction thyroïdienne, avec
une diminution de la TSH qui précède son élévation,
faisant évoquer une période d’hyperthyroïdie transitoire
(3). Un tableau d’hyperthyroïdie a d’ailleurs été observé
dans 3 autres séries, avec apparition d’une hyperthy-
roïdie chez 25 % des sujets traités par sunitinib pour un
cancer du rein (8, 10, 11). L’absence de glande thyroïde
visualisée lors de l’échographie de 2 patientes hypothy-
roïdiennes, l’augmentation du niveau de thyroglobuline
et la diminution du captage iodé renforcent l’hypo-
thèse d’une thyroïdite destructrice (3, 11). Des travaux
expérimentaux réalisés sur des animaux indiquent que
l’inhibition du signal relayé par le VEGFR est responsable
d’une régression capillaire réversible qui atteint 68 %
du tissu thyroïdien (12, 13). De plus, les souris traitées
par inhibiteurs du VEGFR ont un phénotype hormonal
d’hypothyroïdie. Le VEGF et ses récepteurs sont en effet
exprimés par les cellules folliculaires thyroïdiennes (14).
Le sunitinib inhibant le signal VEGF pourrait ainsi altérer
la vascularisation intrathyroïdienne, engendrer une
hypoxie cellulaire et rendre ainsi compte du tableau
de thyroïdite destructrice.
Ce mécanisme vasculaire n’est peut-être pas le seul :
on observe chez la majorité des patients sous sunitinib
une réduction du captage iodé en période on , qui est
rapidement réversible en période off (4). Cette réduction
pourrait être responsable d’une hypothyroïdie, puisqu’il
existe une relation négative entre le captage iodé et les
concentrations de TSH au cours des périodes on et off.
Toutefois, sur des cellules de rat FRTL-5, le sunitinib aug-
mente le captage iodé induit par la TSH sans modifier
l’expression de l’ARN messager du symporteur d’iodure
NIS (15). De même, l’efflux d’iode n’est pas modifié (15).
Une autre action du sunitinib serait l’inhibition de l’acti-
vité thyropéroxydase, qui pourrait atteindre 25 à 30 %
de l’inhibition induite par le propylthiouracile (5). Cet
effet expliquerait la latence observée entre l’institution
du sunitinib et l’apparition de l’hypothyroïdie, qui ne se
développerait qu’après épuisement du stock hormo-
nal intrathyroïdien. Contrairement aux modifications
induites par l’interféron, l’immunité ne semble pas jouer
un rôle important dans le risque d’hypothyroïdie. Seuls
4 à 10 % des sujets traités par sunitinib développent
des anticorps antithyroglobuline (7, 8). Si les altérations
du captage et de l’organification iodés peuvent être
impliquées dans les mécanismes de l’hypothyroïdie,
elles n’expliquent pas la période d’hyperthyroïdie qui
précède. L’hypothèse de la thyroïdite destructrice
reste donc valable, même si celle-ci ne rend proba-
blement pas compte de tous les cas d’hypothyroïdie
sous sunitinib.
Imatinib (Glivec
®
)
Données cliniques
L’imatinib cible la protéine de fusion de BCR-ABL, KIT et
les récepteurs du PDGF (2). Les données cliniques rela-
tives à l’effet de l’imatinib sur la fonction thyroïdienne
sont peu nombreuses, concernant moins de 30 sujets
et dérivant toutes de l’équipe de J.W. de Groot. En 2005,
l’effet de l’imatinib a été étudié chez 10 patients traités
pour un carcinome médullaire thyroïdien (CMT) [16]. Les
seuls sujets présentant une élévation de la TSH (supé-
rieure à 5 fois la normale) sont les patients thyroïdec-
tomisés ; les 3 patients non thyroïdectomisés gardent
des niveaux stables de TSH. Cette hypothyroïdie reste
infraclinique : les niveaux de T4 libre et de T3 libre, bien
que réduits d’environ 60 %, restent dans les valeurs nor-
'JHVSF Variations du taux de TSH au cours des différents cycles de traitement par sunitinib
chez un patient porteur d’un cancer du rein métastatique. Les zones grisées correspondent aux
périodes on et les zones blanches aux périodes off du traitement. La zone hachurée indique les
normes TSH (0,35-4,5 mUI/l). [Avec la permission du Dr Damatte-Fauchery.]
0
20
40
– 4 0 2
Début de la
lévothyroxine
Reprise de la
lévothyroxine
Arrêt de la
lévothyroxine
TSH (mUI/l)
4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34
60
140
Semaines

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 7 - septembre 2011
237
Modification de la fonction thyroïdienne par les inhibiteurs de tyrosine kinases
males. Dans une autre série, de Groot et al. retrouvent
les mêmes résultats, avec une augmentation de plus
de 200 % des besoins substitutifs en lévothyroxine (17).
Contrairement au sunitinib, l’effet apparaît rapidement
et est réversible après arrêt du traitement (16).
Une modulation du métabolisme hormonal
Aucune étude ne s’est intéressée à l’effet de l’imatinib
sur le tissu thyroïdien. L’absence d’effet de l’imatinib
sur la fonction thyroïdienne des sujets non thyroïdec-
tomisés exclurait une action propre de la molécule sur
le tissu thyroïdien (16, 17). Dora et al. ont confirmé que
l’imatinib ne modifiait pas la fonction thyroïdienne
chez 68 sujets avec thyroïde en place (18). Ainsi, l’ima-
tinib pourrait interagir avec le métabolisme de la T4.
L’absorption de lévothyroxine ne semble pas être
altérée : l’administration séparée de la lévothyroxine
et de l’imatinib ne modifie pas les niveaux de TSH.
L’absence de changement des niveaux de thyroxine-
binding globulin (TBG) et de thyroxine totale n’est pas
en faveur d’une modification de la liaison entre la T4 et
sa protéine porteuse, ni d’une altération des désiodases
(16). L’une des hypothèses serait donc une stimulation
de la clairance hormonale de la T4 et de la T3 par induc-
tion des uridines diphosphate-glucuronosyltransférases
(UGT) [16, 19]. Cependant, aucune interaction n’a jamais
été démontrée entre les UGT et l’imatinib.
Motésanib (AMG 706)
Données cliniques
Le motésanib cible les TK impliquées dans les processus
vasculaires tels les VEGFR, le PDGFR ainsi que KIT et
RET (2). Dans 2 essais de phase II, 91 patients porteurs
d’un cancer différencié thyroïdien (CDT) et 93 d’un CMT
ont été traités par motésanib (20, 21). Après un suivi
médian de 50 semaines, 41 % de ces sujets thyroïdecto-
misés porteurs d’un CDT et 22 % des sujets porteurs
d’un CMT présentaient au moins une fois durant le suivi
une élévation de la TSH ou une hypothyroïdie et une
majoration des besoins en lévothyroxine.
Effet vasculaire
et effet sur le métabolisme hormonal
L’augmentation des besoins en lévothyroxine chez
les patients thyroïdectomisés suggère un effet indi-
rect sur le métabolisme des hormones thyroïdiennes
(20, 21). De plus, chez la souris, le motésanib inhibe
la prolifération des cellules endothéliales et réduit la
perméabilité vasculaire induite par le VEGF (22). Dans
des modèles de xénogreffe, le motésanib réduit la
croissance tumorale et induit une régression tumo-
rale, après une action proapoptotique sur les cellules
endothéliales. Le motésanib pourrait donc interagir
avec la fonction thyroïdienne par un mécanisme de
réduction vasculaire, comme le sunitinib, et aussi par
une modification du métabolisme des hormones thy-
roïdiennes, comme l’imatinib.
Sorafénib (Nexavar
®
)
Données cliniques
Le sorafénib est aussi un ITK qui cible de multiples pro-
téines TK : VEGFR, récepteur β du PDGF, KIT, RET, BRAF (2,
23). Une étude a analysé 39 sujets traités par sorafénib
pour cancer du rein (24). Après 2 à 4 mois d’exposition,
18 % des patients présentaient une hypothyroïdie, dont
un quart a développé des anticorps antithyroglobuline.
L’hypothyroïdie persisterait après l’arrêt du sorafénib.
Dans une étude concernant 33 patients porteurs d’un
CDT réfractaire, une adaptation de la substitution hor-
monale a été nécessaire pour 10 d’entre eux afin de
maintenir la TSH dans les valeurs souhaitées (25). Une
autre étude concernant 31 patients traités pour CDT
métastatique rapporte la nécessité d’adapter la substi-
tution à la hausse ou à la baisse chez 11 d’entre eux (26).
Un effet plutôt vasculaire
Dans les modèles de xénogreffe, le sorafénib inhibe les
voies de signalisation des VEGFR et PDGFR, ce qui réduit
l’angiogenèse (23, 27). Dans les xénogreffes orthoto-
piques de CMT, le sorafénib favorise l’apoptose des cel-
lules endothéliales (28). Cet effet pourrait expliquer les
tableaux de thyroïdite destructive récemment supposée
(26) ou rapportée, avec réduction du volume thyroïdien
(29, 30). De plus, le sorafénib diminue la prolifération
et la survie des cellules tumorales par inhibition de la
voie RAF/MEK/ERK (23, 27). Toutefois, à ce jour, l’effet
antiprolifératif et antivasculaire sur le tissu thyroïdien
sain n’a pas été étudié. Le sorafénib pourrait égale-
ment interagir avec la voie de signalisation de la TSH :
il a en effet été montré que la transduction du signal
TSH impliquait la voie des RAF kinases (31). D’autres
études seront nécessaires pour mieux appréhender
l’hypothyroïdie induite par le sorafénib.
Vandétanib (Zactima
®
)
Le vandétanib exerce une action antiangiogénique par
ses cibles (VEGFR, EGFR), ainsi qu’une action sur RET
(32). Dans une étude concernant 19 patients porteurs

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 7 - septembre 2011
238
dossier thématique
d
d
d
d
d
d
d
d
d
d
d
d
d
d
d
o
o
o
o
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
s
i
i
e
e
e
e
r
r
r
t
t
t
t
h
h
h
h
h
é
é
é
é
é
é
é
é
é
m
m
m
m
m
m
a
a
a
tt
t
t
t
i
i
i
i
q
q
q
q
q
u
u
u
u
u
e
e
e
Endocrinopathies
induites par les traitements
anticancéreux
d’un CMT métastatique, une élévation de la TSH entre
4 et 5 fois la valeur basale est objectivée, avec une
majoration de la substitution en lévothyroxine chez
2 patients (33). La fonction thyroïdienne n’a pas été éva-
luée dans l’essai ZETA 3, qui étudie le bénéfice du van-
détanib dans les CMT métastatiques (34). Cependant,
l’expérience clinique confirme la nécessité de majorer
la lévothyroxine chez les patients thyroïdectomisés
sous vandétanib. Aucune modification de la fonction
thyroïdienne n’a été rapportée à ce jour dans les autres
essais étudiant le vandétanib, où les patients devaient
avoir une thyroïde en place. Cela laisse à penser que la
majoration des besoins en lévothyroxine sous vandéta-
nib signe davantage une modification de l’absorption
ou du métabolisme de la lévothyroxine, le vandétanib
n’entraînant probablement pas d’atteinte thyroïdienne
à proprement parler.
Nilotinib (Tasigna
®
)
Le nilotinib cible les protéines BCR-ABL, c-KIT et le
PDGFR (35). Une série récente a inclus 55 patients
porteurs d’une leucémie myéloïde chronique (LMC) et
traités par nilotinib (35). Même si l’analyse des résultats
est difficile du fait que certains patients présentaient au
départ une maladie thyroïdienne, une hypothyroïdie et
une hyperthyroïdie apparaissent respectivement chez
22 % et 33 % des sujets. Certains patients présentent un
tableau de thyroïdite destructive, avec une hyperthyroï-
die suivie d’une hypothyroïdie, souvent spontanément
régressive (35, 36), ce qui laisse envisager un processus
vasculaire prédominant.
Dasatinib (Sprycel
®
)
Dans l’étude de Kim et al., parmi les 10 patients traités
par dasatinib, 5 présentent une hypothyroïdie (2 étaient
déjà en hypothyroïdie avant le traitement) et 2 pré-
sentent une hyperthyroïdie (35). Une hypothyroïdie
vraie est objectivée chez un seul patient. Cette étude,
qui est le seul travail rapportant un effet du dasatinib sur
la fonction thyroïdienne, ne permet pas d’appréhender
le mécanisme sous-jacent.
Prise en charge des modifications
de la fonction thyroïdienne sous ITK
L’introduction de tout ITK nécessite une évaluation hor-
monale préalable et durant le traitement. Le sunitinib
étant le plus étudié, Wolter et al. proposent un schéma
de surveillance s’appuyant sur le dosage de la TSH aux
premier et dernier jours de la période on des 4 premiers
cycles, puis tous les 3 cycles si les premiers résultats
sont normaux (8). Le moment de l’introduction de la
lévothyroxine peut être délicat sous sunitinib lorsque
celui-ci est proposé de façon cyclique. L’élévation de la
TSH en fin de période off implique que l’hypothyroïdie
est constituée et qu’elle ne pourra que se majorer durant
la période on, ce qui motivera la prescription de lévo-
thyroxine. En revanche, une élévation de la TSH durant
la période on peut se normaliser durant la période off
et pourrait être responsable d’une hyperthyroïdie si un
traitement par lévothyroxine était introduit. Ainsi, la TSH
en fin de période on semble utile au diagnostic d’hypo-
thyroïdie. En cas d’élévation, la TSH doit être contrôlée
en fin de période off afin de décider de l’introduction
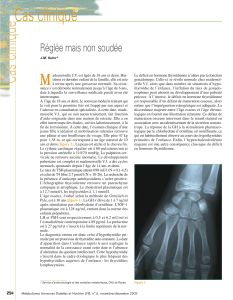
de la substitution. La figure 2 propose une stratégie
de dépistage des dysfonctions thyroïdiennes ainsi que
leur prise en charge. Lors d’un traitement continu par
sunitinib, une surveillance mensuelle de la TSH pourra
être recommandée, comme cela doit être le cas avec
l’imatinib, le sorafénib ou le vandétanib, compte tenu
des majorations des besoins substitutifs souvent néces-
saires. Toutefois, seule l’évaluation systématique de
la fonction thyroïdienne lors des essais cliniques de
phases II et III permettra d’améliorer nos connaissances
sur l’effet thyroïdien des ITK et de proposer une straté-
gie diagnostique et thérapeutique adaptée à chaque
molécule.
'JHVSF Proposition de stratégie de dépistage des anomalies de la fonction thyroïdienne
sous sunitinib.
TSH en préthérapeutique du traitement par sunitinib
Traitement
approprié
Lévothyroxine
TSH à J28
TSH à J28/lors des
2 cycles suivants,
puis 1 fois/3 cycles
TSH en fin
de période off
Dosage de T4
libre pour
adaptation
thérapeutique
abaissée
abaissée
élevée
élevée
élevée
normale
normale
normale
 6
6
1
/
6
100%