Le cortex operculo-insulaire, les processus thermosensoriels et la

La Lettre du Neurologue ̐˫˭ϴ͊˭͉͇͈͉| 79
ÉDITORIAL
”
“
R. Peyron
Département de neurologie, CHU
de Saint-Étienne, Inserm U879, UCB
Lyon 1, UJM Saint-Étienne, PRES de Lyon.
Le cortex operculo-insulaire,
les processus thermosensoriels
et la douleur
e insular cortex, thermo sensory processes
and pain
Nous avons fêté en 2011 les 20ans d’application de l’imagerie fonctionnelle
àl’étude de la douleur. Avec ce recul, il semble important de revenir
sur un passé récent, celui des années 1990, où l’on considérait que les aires
recevant les informations thermosensorielles et nociceptives étaient le cortex
somatosensoriel primaire (SI), le thalamus, et éventuellement l’aire somatosensorielle
secondaire (cortex somatosensoriel secondaire [SII]). Les premières surprises apportées
par les études initiales étaient que le SI et le thalamus ne présentaient de modifications
hémodynamiques face à une stimulation nociceptive que dans environ 50% des cas.
C’est ensuite l’accumulation des résultats avec la TEP ou l’IRMf qui a permis de décou-
vrir que d’autres aires, non suspectées jusqu’alors, répondaient de manière constante ou
quasi constante à une expérience douloureuse chez le volontaire sain. Ces techniques
ont eu comme particularité intéressante le fait d’avoir exploré l’ensemble du cerveau,
sans a priori, et donc d’avoir apporté la possibilité de découvrir des aires importantes
jusqu’alors non suspectées. Plusieurs études se sont ensuite focalisées sur les activations
cingulaires antérieures, avant que, plus récemment, des travaux constatent que les aires
les plus constamment impliquées lors d’une stimulation douloureuse étaient les cortex
insulaires et operculaires (1). Notre équipe a d’ailleurs publié en 1999 un résultat
indiquant que, après avoir neutralisé l’aspect attentionnel associé à une stimulation
douloureuse, celle-ci pouvait avoir comme seule traduction sur les réponses cérébrales,
une activation restreinte aux 2seuls cortex operculo-insulaires.
Récemment, nos connaissances dans le domaine de la physiologie de la douleur se sont
enrichies, avec l’apport de nouvelles techniques appliquées à l’étude de la douleur
etorientées vers les régions cérébrales identifiées par l’imagerie fonctionnelle,
comme jouant un rôle dans les processus nociceptifs. Ces techniques tirent parti
del’implantation d’électrodes intracérébrales en différents sites corticaux,
chezdespatients candidats à une chirurgie de l’épilepsie. Des enregistrements
intracérébraux ont ainsi permis de démontrer que les aires operculo-insulaires
enregistraient des réponses stéréotypées (potentiel évoqué) à des stimulations laser
douloureuses mettant en jeu la voie spino-thalamique. Ces réponses, bien que non
exclusivement localisées dans les aires operculo-insulaires (elles ont aussi été
enregistrées dans le cortex cingulaire antérieur et dans le cortex moteur primaire),
présentent 2caractéristiques: les réponses nociceptives sont les mieux individualisées
parmi toutes celles qui ont pu être enregistrées et elles ont une amplitude corrélée aux
scores de douleur, ce qui témoigne d’une certaine spécialisation dans le codage
fin de l’intensité douloureuse (2). Une deuxième technique utilise les stimulations
électriques sur les mêmes électrodes implantées et collecte les sensations évoquées
par ces stimulations électriques. Depuis les travaux de W. Penfield et H. Jasper (3),
ilest connu que la stimulation du cortex n’induit qu’exceptionnellement des sensations
douloureuses. Dans un article récent, L. Mazzola et al. (4) ont confirmé ces données
sur plus de 4000stimulations largement distribuées à travers le cerveau.
Une exception à cette absence de douleur évoquée par la stimulation cérébrale directe
a été l’aire operculo-insulaire, très peu explorée par l’équipe de Montréal.
1. Peyron R, Laurent B, García-
Larrea L. Functional imaging of brain
responses to pain. A review and meta-
analysis (2000). Neurophysiol Clin
2000;30(5):263-88.
2. Frot M, Magnin M, Mauguière F et al.
Human SII and posterior insula diffe-
rently encode thermal laser stimuli.
Cereb Cortex 2007;17(3):610-20.
3. Penfield W, Jasper H. Epilepsy and
the functional anatomy of the human
brain. Boston: Brown L; 1954.
4. Mazzola L, Isnard J, Peyron R et al.
Stimulation of the human cortex
and the experience of pain: Wilder
Penfield’s observations revisited.
Brain 2012;135(Pt 2):631-40.

80 | La Lettre du Neurologue ̐˫˭ϴ͊˭͉͇͈͉
ÉDITORIAL
Or, il apparaît que, lorsqu’une sensation douloureuse est évoquée par une stimulation
profonde du cerveau, la zone de stimulation est constamment le cortex operculo-
insulaire controlatéral à la douleur. Le taux d’obtention d’une douleur après stimulation
de l’aire operculo-insulaire atteint 11%. Pourtant, ces stimulations destinées à évaluer
la propagation de la décharge épileptique étaient de faible intensité et n’étaient pas
réalisées avec l’objectif d’obtenir une douleur, si bien que le potentiel nociceptif de cette
aire est probablement minoré dans cette étude.
Ainsi, l’aire operculo-insulaire apparaît de manière relativement spécifique comme une
aire d’intégration de la sensation douloureuse, que l’on considère les données de
l’imagerie fonctionnelle, des enregistrements intracorticaux, ou des stimulations
corticales. La démonstration qu’il existe un cortex nociceptif primaire ne peut être
apportée que si une excitation anormale des neurones de cette région induit de la
douleur et/ou si une lésion sélective de ce cortex induit une perte de la fonction
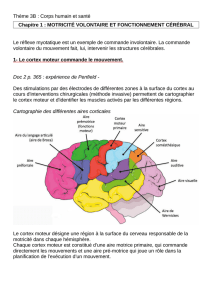
nociceptive. Ces 2étapes ont été franchies en pathologie neurologique (figure).
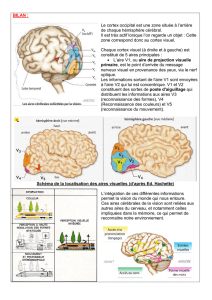
Figure.
1. Données d’imagerie fonctionnelle. Les augmentations de signal (BOLD ou débit) obtenues respectivement en
IRMf ou en TEP sont projetées sur l’IRM anatomique moyenne des sujets volontaires. Ces “réponses” comparent le
signal dans 2 conditions de stimulation thermique de la main droite, l’une au-dessus du seuil de douleur, et l’autre en
dessous du seuil. Dans certaines situations attentionnelles, les réponses cérébrales à la douleur peuvent se limiter à
une activation operculo-insulaire bilatérale, comme représenté ici.
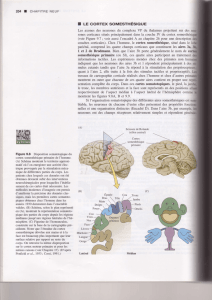
2. Enregistrement des réponses électriques cérébrales à une stimulation douloureuse par laser de la main, par le biais
d’électrodes implantées pour des raisons épileptologiques. Les électrodes situées dans le cortex operculo-insulaire
permettent d’enregistrer un potentiel nociceptif à la stimulation laser, distinct dans le SII et dans l’insula, avec une
amplitude de réponse corrélée à l’intensité de la sensation douloureuse (2).
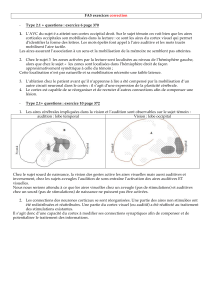
3. Stimulation intracérébrale directe. La stimulation n’induit pas de sensation douloureuse excepté lorsqu’elle
concerne le cortex operculo-insulaire. Une stimulation de faible intensité dans cette aire peut induire une sensation
douloureuse dans 11 % des cas (4).
4. Le modèle d’hyperexcitabilité neuronale est représenté ici par une décharge épileptique qui naît dans le cortex
operculo-insulaire. La naissance ou la propagation d’une décharge épileptique dans cette région se traduit par un
symptôme douloureux (5).
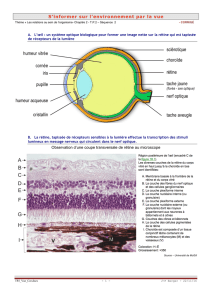
5. Le modèle de lésions operculo-insulaires est représenté ici par cet infarctus limité, se traduisant par une perte de
sensibilité thermique incluant une perte de sensation douloureuse pour des températures habituellement nociceptives.
Dans un certain nombre de cas, ces lésions peuvent se compliquer par la survenue de douleurs neuropathiques centrales.

La Lettre du Neurologue ̐˫˭ϴ͊˭͉͇͈͉| 81
ÉDITORIAL
”
Ces dernières années, les épilepsies insulaires et leur symptômes ont été redécouverts,
dont le symptôme douloureux. Très peu de crises épileptiques comportent
des symptômes douloureux somatiques et explicites, à l’exception des crises originaires
de l’insula ou des crises propagées à ce cortex. Les enregistrements de crises
épileptiques avec électrodes intra-insulaires montrent que la sensation douloureuse
induite par les décharges épileptiques concerne celles de topographie insulaire (5).
Dans le domaine lésionnel, il est maintenant admis que des lésions circonscrites
de l’aire operculo-insulaire s’accompagnent d’une perte de sensibilité thermo-algique,
mais aussi d’une élévation des seuils à la douleur et d’une disparition du potentiel
évoqué nociceptif (6).
Ces données confortent l’hypothèse que des structures profondes et de fonctions
méconnues − comme le cortex operculo-insulaire − interviennent de manière cruciale
dans le processus nociceptif. Les arguments sont nombreux pour considérer
que ce cortex à la fonction thermosensorielle établie dans sa partie postérieure
etsupérieure puisse aussi inclure une fonction nociceptive thermique. Même
si les modèles lésionnels peuvent être en faveur d’une fonction nociceptive primaire,
cette question reste plus incertaine, car les processus nociceptifs pourraient aussi
concerner d’autres aires insulaires dont les parties antérieure et inférieure sont
difficilement explorables par des électrodes implantées en raison d’un risque vasculaire.
5. Isnard J, Guénot M, Sindou M et al.
Clinical manifestations of insular
lobe seizures: a stereo-electro-
encephalographic study. Epilepsia
2004;45(9):1079-90.
6. Garcia-Larrea L, Perchet C,
Creac’h C et al. Operculo-insular
pain (parasylvian pain): a distinct
central pain syndrome. Brain
2010;133(9):2528-39.
AVIS AUX LECTEURS
Les revues Edimark sont publiées en toute indépendance et sous l’unique et entière responsabilité du directeur de la publication et du rédacteur
en chef.
Le comité de rédaction est composé d’une dizaine de praticiens (chercheurs, hospi taliers, universitaires et libéraux), installés partout en France,
qui représentent, dans leur diversité (lieu et mode d’exercice, domaine de prédilection, âge, etc.), la pluralité de la discipline. L’équipe se réunit 2
ou 3 fois par an pour débattre des sujets et des auteurs à publier.
La qualité des textes est garantie par la sollicitation systématique d’une relecture scientifique en double aveugle, l’implication d’un service de
rédaction/révision in situ et la validation des épreuves par les auteurs et les rédacteurs en chef.
Notre publication répond aux critères d’exigence de la presse :
· accréditation par la CPPAP (Commission paritaire des publications et agences de presse) réservée aux revues sur abonnements,
· adhésion au SPEPS (Syndicat de la presse et de l’édition des professions de santé),
· indexation dans la base de données INIST-CNRS,
· déclaration publique de conflit d’intérêts demandée à nos auteurs,
· identification claire et transparente des espaces publicitaires et des publi-rédactionnels en marge des articles scientifiques.
1
/
3
100%