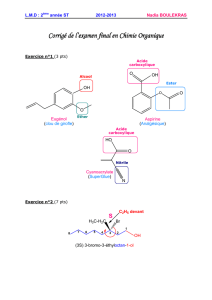
Cours de Chimie Organique du 20 Novembre (version

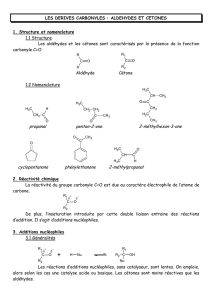
RAPPELS ET PRECISIONS

Plan de la séance
I) Notions fondamentales et
éléments de vocabulaire
•Attaques
•Stéréosélectivité
•Eléments de nomenclature
•Catalyse basique
•Contrôle cinétique et
thermodynamique
II) Abord de la chimie organique et
méthodes :
•Le polycopié
•Structuration du cours
•Bilans et mécanismes
•Compréhension
•Exercices et conseils généraux
III) Mécanismes particuliers IV) Annexes

NOTIONS
FONDAMENTALES ET
ELEMENTS DE
VOCABULAIRE

Réactivité = déplacements d’électrons
On parle alors d’attaques
Attaques non au hasard :
•Site nucléophile (riche en électrons) site électrophile
(pauvre en électrons)
ATTAQUES

Attaque a une direction préférentielle parfois:
•C’est le cas d’une SN2 en anti
Voyons quelques exemples ci-après
ATTAQUES
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%