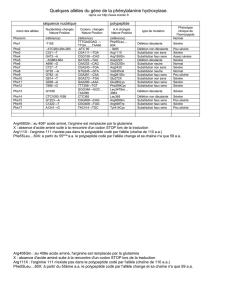
6.1, Les types de réactions chimiques, PowerPoint

Les types de réactions
chimiques
PowerPoint 6.1

Six types de reaction à connaître
1. La combination (synthèse)
2. La decomposition
3. La substitution simple
4. La substitution double
5. La neutralisation (acide-base)
6. La combustion

1. La combination (synthèse)
Métal + → Composé ionique
Des métaux transfèrent un ou plusieurs élecctrons aux non-métaux pour
former un composé ionique.
Des non-métaux peuvent aussi réagir ensemble pour former un compose
covalent, un molécule.
2N2+ → 2N2O
Les éléments peuvent être des métaux ou des non métaux.
Li + → LiF
F
Li F
Li +→Li F
+-Li F
+-
22

2. La décomposition
AB → A+
Le contraire d’une réaction de combinaison.
L’équation générale, composé →élément +
Exemple, H2O→ + H2
Lors de la decomposition d’un composé ionique, des éléctrons sont
retournés au métal, produisant des éléments neutres comme produits.
Exemple, 2NaCl → 2Na +
O
H
H
O
H
H
→O
OH
H
+H
H
2 2

3. La substitution simple
Un des éléments du composé est remplacé avec un autre élément.
A+ CB → B + AC
A+ CB → C + AB
Exemple, 2Al + 3CuCl2→ 3Cu + 2AlCl3
L’ équation générale, élément + composé → + composé
Exemple, F2+ 2NaI → I2+ 2NaF
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%