Spectre de l`hydrogène atomique: De l`observation à la modélisation

Spectre de l’hydrogène atomique: De l’observation à la modélisation
Auteurs: Marie Joëlle Ramage et Michèle Chevalier, Université Paris Sud, 91405 Orsay
Résumé :
Nous présentons ici un nouvel outil pour l’étude de la spectroscopie atomique constitué d’un travail
expérimental couplé à un travail de modélisation sur ordinateur.
Les étudiants observent le spectre visible émis par une lampe à hydrogène et mesurent les longueurs
d’onde des raies avec un spectromètre. Puis, en salle multimédia, ils modélisent ce spectre à l’aide d’un
logiciel. En fin de séance, l’étudiant doit avoir reproduit la série de Balmer et simulé celles de Lymann et
Paschen. Il doit être capable de calculer les énergies des niveaux et des transitions.
I) Introduction
Le cours de chimie de première année à la faculté des sciences comporte une partie sur la
spectroscopie des hydrogénoïdes. Nous expérimentons actuellement un nouvel outil créé après avoir
identifié quelques difficultés des étudiants pour:
• Relier l’énergie de photon et la longueur d’onde de la radiation pour la lumière,
• admettre que l’énergie du photon émis est égale à la variation de l’énergie de l’atome lors d’une
désexcitation atomique,
• définir une énergie de référence,
• représenter une série. Ceci vient à l’encontre de l’idée spontanée des étudiants qui tracent des
transitions d’un unique niveau supérieur vers autant de niveaux inférieurs qu’il « faut ».
Cet outil permet, à partir de l’observation d’un spectre, de construire un ensemble de niveaux
électroniques pour l’hydrogène. Il est fortement inspiré du didacticiel de Chandima Cumaranatunge et
Sanjay Rebello de Kansas State University1.
II) Partie expérimentale
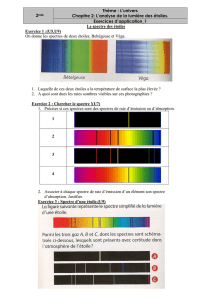
Les étudiants observent des spectres d’émission de différentes sources: Des spectres continus (soleil),
des spectres discrets (lampe à mercure, lampe à hydrogène). L’émission d’une lampe à Hydrogène est
ensuite envoyée à travers un spectromètre et les longueurs d’onde des raies sont mesurées.
Cette partie permet de rappeler les notions de spectres continus ou discrets et de longueurs d’onde du
photon (associée à une couleur dans le visible). Elle permet également aux étudiants de voir réellement
des spectres d’émission alors qu’en cours l’émission est présentée au « tableau noir ».
III) Partie simulation
Le didacticiel permet à partir de la reconstitution du spectre de l’hydrogène observé d’introduire un
modèle quantique pour représenter les niveaux d’énergie de l’atome d’hydrogène. Constitué d’un guide
d’activité couplé à un simulateur de spectre, il comprend des feuillets successifs : la question, l’activité 1,
l’activité 2 et la validation. Nous résumons ci dessous les buts et contenus de ces différents feuillets.
La question
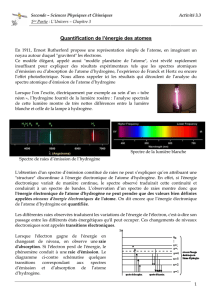
Ce premier feuillet oblige à réfléchir avant d’agir. Partant de la photographie du spectre d’émission de
l’hydrogène, une présentation de l’idée de Bohr de quantification des énergies de l’atome est faite. La
question se pose alors: Comment trouver les énergies des niveaux à partir du spectre de l’hydrogène?
L’activité 1
Cette activité familiarise l’étudiant avec le simulateur mais attire aussi son attention sur deux points:
1 Référence sur: http://phys.educ.ksu.edu/vqm/html/emission.html

1.Les raies d’émission sont dues à une perte d’énergie par l’atome, correspondant à une transition
entre deux niveaux. On insiste sur la relation : Energie de la raie = différence d’énergie entre les niveaux
de l’atome. Dans le simulateur, une échelle verticale donne l’énergie de l’atome et une échelle horizontale
donne celle de la raie (donc la différence d’énergie entre les niveaux).
2.Comment trouver le nombre de raies que l’on peut créer pour un nombre de niveaux donnés quand il
n’y a pas de transition interdite? Beaucoup d’étudiants ajoutent un niveau chaque fois qu’ils veulent créer
une raie.
L’activité 2
Cette activité introduit le modèle quantique pour représenter les niveaux de l’Hydrogène.
Une première étape (graphique) permet de reproduire le spectre visible puis de prévoir les spectres
IR et UV en positionnant des niveaux d’énergie. Deux remarques sur cette activité :
• Le spectre visible étant reproduit, les transitions IR s’obtiennent à partir du même ensemble de
niveaux. Le spectre UV oblige à ajouter un niveau (le fondamental).
• La position absolue en énergie des niveaux est aléatoire (mais les écarts doivent être respectés).
Une deuxième étape introduit la formule de Rydberg qui reproduit les énergies des transitions dans le
visible. Cette relation fait apparaître une différence de termes qu’il est tentant d’assimiler à des énergies
de niveaux. Les étudiants calculent les énergies des raies ce qui les oblige à « s’approprier » cette
formule.
Une troisième étape permet de fixer une origine pour les énergies des niveaux.
Une question sur l’origine des énergies de l’atome fait prendre conscience aux étudiants qu’il faut une
hypothèse supplémentaire pour « caler » les niveaux de l’atome. L’énergie nulle est fixée pour la limite de
dissociation. Connaissant le potentiel d’ionisation, l’énergie du niveau fondamental est alors fixée. A ce
stade, les étudiants doivent déplacer l’ensemble du schéma des niveaux pour caler le niveau
fondamental. Les énergies des autres niveaux sont alors connues également.
Vient ensuite une identification des termes de la formule de Rydberg avec les énergies des niveaux et la
définition du nombre quantique principal n. Les difficultés viennent d’une part du lien entre n = +∞ et l’état
dissocié et d’autre part, du fait que la relation de Balmer-Rydberg ne fait pas intervenir le niveau
fondamental.
A partir de la formule de Rydberg et du schéma des niveaux, on pourrait identifier le numéro de niveau
avec le nombre quantique principal. Dans ce cas, on obtiendrait l’énergie des niveaux et la limite de
dissociation pour n = +∞ , mais il serait plus difficile de montrer la nécessité de définir une origine des
énergies.
III-4) Validation
Ce n’est pas la validation du modèle qui est recherchée mais celle de l’apprentissage. Nous demandons
aux étudiants de retracer le parcours suivi pour établir leur résultat afin qu’ils prennent conscience de
chaque étape et qu’ils se demandent si ils l’ont comprise.
IV Conclusion
Cet apprentissage fonctionne depuis deux années seulement. Des difficultés de mise en place de
l’appliquette, de formation des enseignants (à l’utilisation de la salle multimédia) ont été rencontrées.
Certains étudiants sont plus gênés par des problèmes liés à l’utilisation d’un ordinateur qu’au modèle lui-
même. Malgré cela il nous a semblé que cette activité était profitable aux étudiants. Ceux ci ont d’ailleurs
fait bon accueil à cette activité. Le module de cours correspondant est très théorique et les étudiants ont
beaucoup apprécié d’avoir une partie expérimentale en liaison avec ce cours.
1
/
2
100%