HHV-6 - outcomerea

HHV-6
BIOLOGIE,
ASPECTS CLINIQUES
ET THERAPEUTIQUES
Dr G Ko
Microbiologie
GHU OUEST

GENERALITES
•Le plus proche du CMV.
•Découvert en 1986, isolé chez des patients
immunodéprimés (SIDA, lymphome et
leucémie) à partir de cellules
mononucléées et appelé Human B-
lymphotrope virus
•Un tropisme pour les lymphoT et non pas
B.

HHV-6
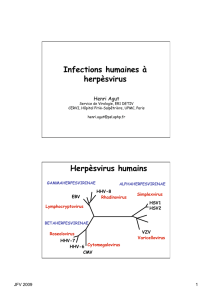
•Famille des
Betaherpesvirinae
,
comprenant :
–CMV
–HHV-6
–HHV-7
•- cycle de réplication long, supérieur à 48h
- tropisme restreint
-spécificité d’hôte très étroite
in vivo

Structure

HHV-6 : PROPRIETES
VIROLOGIQUES
•Tropisme pratiquement exclusif pour les cellules
humaines :
–Lymphocytes T (CD4+ et CD8+)
–Monocytes-macrophages
–Cellules épithéliales
–Cellules nerveuses.
•Deux variants A et B du HHV-6 distincts par :
–Propriétés phénotypiques (conditions de
culture, tropisme)
–Réactivité antigénique vis à vis de certains
anticorps monoclonaux
–Séquence nucléotidique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%