CHMI 2227E Biochemistry I

CHMI 2227 - E.R. Gauthier, Ph.D. 1
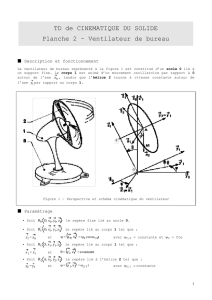
CHMI 2227F
Biochimie I
Protéines:
-Structure secondaire
-Hélice alpha

CHMI 2227 - E.R. Gauthier, Ph.D. 2
Structure secondaire
Réfère à la structure spatiale
adoptée par des acides aminés
adjacents sur une portion
seulement de la protéine;
Les liaisons hydrogène jouent un
rôle important pour stabiliser les
conformations de structures
secondaires;
Les deux types principaux sont:
l’hélice alpha et le feuillet bêta
http://www.fiu.edu/~bch3033/Handouts/Lh4Ch04Prot.pdf

CHMI 2227 - E.R. Gauthier, Ph.D. 3
Hélice Alpha
L’hélice α a été proposé en 1950 par Linus
Pauling et Robert Corey;
Ils ont considéré les dimensions des groupes
peptidiques, les contraintes stériques possibles
ainsi que la possibilité de stabilisation par
formation de liaisons hydrogène;
Leur modèle explique très bien la structure
observée dans la protéine fibreuse appelée α-
kératine;

CHMI 2227 - E.R. Gauthier, Ph.D. 4
Hélices de pas droit et gauche
Une hélice α pourrait être
aussi bien droite que
gauche, mais, construite
avec des acides aminés
L, la conformation gauche
est déstabilisée par une
interférence stérique;
Alors, les hélices α
présentes dans les
structures protéiques sont
presque toujours droites http://www.fiu.edu/~bch3033/Handouts/Lh4Ch04Prot.pdf

CHMI 2227 - E.R. Gauthier, Ph.D. 5
Structure Hélice Alpha
http://www.ccrc.uga.edu/~dmohnen/bcmb3100/lecturenoteschap4-06-4slides.pdf
La chaîne
polypeptidique
s’enroule sur elle-
même, formant
une hélice droite
d’un pas de
0.56nm (pas =
allongement par
tour), un
incrément de
0.15nm par résidu
d’acide aminé avec
3.6 résidus par
tour
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%