Chapitre 23

2017-04-212017-04-21 1
Thermodynamique
statistique biomoléculaire
GBM2620
Automne 2016
Chapitre 23 de
Molecular Driving Forces
Michael D. Buschmann et Marc Lavertu

2017-04-212017-04-21 2
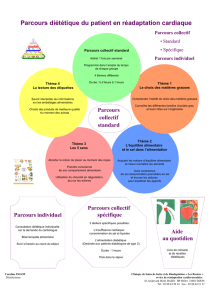
Chapitre 23 : Les ions de sel écrantent
les objets chargés en solution
Un électrolyte est une molécule soluble qui se dissocie en
ions dans un liquide et qui conduit un courant électrique.
Électrolyte fort: dissociation complète des ions
Électrolyte faible: dissociation partielle des ions
Ces ions peuvent contrôler l’équilibre chimique et physique
d’autres objets chargés.
2 cellules biologiques ayant une charge de surface nette négative se
repoussent. L’ajout de sel affaiblit cette répulsion et les 2 cellules se
rapprochent et parfois fusionnent.
L’ajout de sel peut faire précipiter des colloïdes.
L’ajout de sel peut aussi influencer le taux des réactions chimiques.
Michael D. Buschmann et Marc Lavertu

2017-04-212017-04-21 3
Ions en solution
Définition du terme « sel ajouté »:
Une molécule chargée comme l’ADN se vend dans une forme électro-
neutre. i.e. que les contres-ions (Na+ou Mg2+) sont déjà présents de
façon stœchiométrique dans la solution.
Si aucun sel n’est ajouté, la solution reste électro-neutre:
→condition sans sel ajouté
Dans ce chapitre, la condition où du sel est ajouté sera à l’étude.
Les interactions électrostatiques d’objets chargés avec du sel
ajouté peuvent être décrites par l’équation de Poisson et la
condition d’équilibre peut être décrite par la loi de
distribution de Boltzmann. La combinaison de ces deux
équations est:
Michael D. Buschmann et Marc Lavertu
L’équation de Poisson-Boltzmann

2017-04-212017-04-21 4
Le modèle de Poisson-Boltzmann
pour la distribution d’ions de sel
Une molécule ou surface chargée P attire des ions de sel
mobiles de charges opposées (contre-ions) et repousse
ceux de mêmes charges (co-ions).
Les contre-ions sont distribués autour de P et agissent
comme un champ électrostatique.
L’interface entre P et la solution ionique est appelée:
*double couche électrique*
La 1ère couche est la charge de P.
La 2ème couche est l’excès de contre-ions adjacent à P.
La couche de contre-ions réduit le potentiel électrique ressenti par une
particule distante de P.
Michael D. Buschmann et Marc Lavertu

2017-04-212017-04-21 5
Le modèle de Poisson-Boltzmann
pour la distribution d’ions de sel
En l’absence d’électrolyte, deux surface négatives P se repoussent.
Par contre, si du sel est ajouté, la répulsion est affaiblie par la présence des
ions et les deux surfaces se rapprochent.
Les surfaces peuvent même parfois s’associer si les interactions faibles
d’attraction dominent. L’addition de sel peut ainsi induire l’agrégation de
colloïdes.
Michael D. Buschmann et Marc Lavertu
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%









![Cr déjeuner des représentants 4-10-201[...]](http://s1.studylibfr.com/store/data/000257029_1-c85e56035f3e42dcb2b5096af800ff1f-300x300.png)