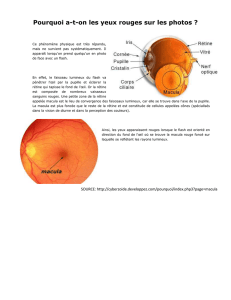
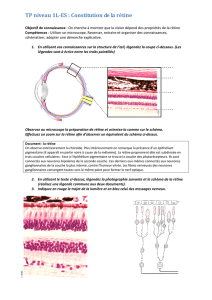
Graphique 1 - Faculté de Médecine et de Pharmacie Fès

UNIVERSITESIDIMOHAMMEDBENABDELLAH
FACULTEDEMEDECINEETDEPHARMACIE
FES
AnnéeThèseN°/201113311
UNIVERSITESIDIMOHAMMED
BENABDELLAH
FES
LEDECOLLEMENTDERETINERHEGMATOGENE
(Aproposde89cas)
THESE
PRESENTEEETSOUTENUEPUBLIQUEMENTLE06/10/2011
PAR
Néele03Janvier1983àTaourirt
Mme.MaadaneAsmae
POURL'OBTENTIONDUDOCTORATENMEDECINE
MOTS-CLES:
Décollement-Rétine-Déchirure-Vitrectomie
JURY
M. Professeur
M. Professeur
M.HARANDOUMUSTAPHA
Professeur
M.LAKTAOUIABDELKADER
Professeur
M. Professeur
TAHRIHICHAM.............................................................
d’Ophtalmologie
NEJJARICHAKIB............................................................
d’Epidémiologieclinique
................................................
agrégéd’Anesthésieréanimation
................................................
agrégéd’Ophtalmologie
BENATIYAANDALOUSSIIDRISS.....................................
assistantd’Ophtalmologie
JUGES
PRESIDENTETRAPPORTEUR
MEMBREASSOCIE

1
PLAN
INTRODUCTION .......................................................................................................... 4
ETUDE THEORIQUE ............................................................................................... 5
I _ Rappel anatomo-physiologique ........................................................................ 5
A. Rappel anatomique ...................................................................................... 5
B. Physiologie rétinienne ................................................................................ 36
II_ Physiopathologie ............................................................................................ 42
III_ Epidémiologie ................................................................................................ 56
IV_ Etude clinique ................................................................................................ 64
V_ Examens complémentaires ............................................................................. 87
VI_ Formes cliniques ........................................................................................... 95
VII_ Diagnostic différentiel ................................................................................. 116
VIII_ Traitement ................................................................................................. 130
IX_ Récupération fonctionnelle.......................................................................... 197
ETUDE PRATIQUE .............................................................................................. 206
I_ Matériel et méthodes ................................................................................... 206
II_ Résultats ...................................................................................................... 210
III_ Discussion ................................................................................................... 253
CONCLUSION ................................................................................................... 266
RESUME ....................................................................................................... 268
BIBLIOGRAPHIE ................................................................................................. 273

2
Liste des abréviations
BAV : baisse d’acuité visuelle
Ca²+ : calcium
CMV : cytomégalovirus
D : dioptrie
DACE : Drain Air-Cryo-Explant
DMLA : Dégénéréscence maculaire liée à l’âge.
DPV : décollement postérieur du vitré
DR : décollement de rétine
ERG : électrorétinogramme
FGF : fibroblast growth factor
FGFR1 : fibroblast growth factor recepteur 1
G : gauge
GMPc : Guanosine mono phosphate cyclique
HA : acide hyaluronique
HSV : herpes simplex virus
IRM : imagerie par résonnance magnétique
LASIK : Laser-Assisted in Situ Keratomileusis
LI : limitante interne
Mg²+ : Magnesium
Na+ : sodium
OCT : Optical Coherence Tomography
PFCL : perfluorocarbone liquide

3
PFO : Perfluoro-n-octane
PL : perception lumineuse
PLSR : ponction de liquide sous rétinien
PTFE : polytetrafluoroéthylene
PVR : prolifération vitréo rétinienne
VEGF : vascular endothelial growth factor
VKH : Vokt koyanagi harada
VZV : varicelle zona virus

4
INTRODUCTION
Le décollement de rétine correspond au clivage entre le neuroépithélium et
l'épithélium pigmentaire. Il n'existe pas de jonction cellulaire entre les franges de
l’épithélium pigmentaire et les articles externes des photorécepteurs. Cet espace virtuel,
occupé par des mucopolysaccharides, est le vestige de la cavité centrale de la vésicule
optique. On parle de décollement de rétine toutes les fois où cet espace virtuel devient
réel et est occupé par du liquide rétro vitréen.
Le décollement de rétine rhegmatogène résulte d’une déhiscence en pleine
épaisseur rétinienne, le plus souvent une déchirure par traction vitréenne.
La prise en charge chirurgicale des décollements de rétine rhegmatogènes découle
de cette connaissance physiopathologique, elle repose sur la fermeture durable de toutes
les déchirures rétiniennes et la création d'une adhérence choriorétinienne forte.
L'indentation externe associée à une rétinopexie a ainsi permis de nombreux succès
anatomiques, dont le pourcentage a nettement augmenté depuis les années 1970 avec
l'essor de la chirurgie endoculaire.
Si le taux de réapplication rétinienne après chirurgie est élevé, force est de
constater que la récupération d'acuité visuelle des patients, opérés avec succès de
décollement de rétine, n'est pas toujours à la mesure du résultat anatomique.
Cette gravité potentielle du décollement de rétine rhegmatogène incite fortement,
malgré sa rareté, à proposer des traitements préventifs.
Le but de notre travail est de mettre le point sur le profil épidémiologique des
décollements de rétine rhegmatogènes, préciser les particularités cliniques,
thérapeutiques et pronostiques de cette affection au CHU Hassan II Fès.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
 211
211
 212
212
 213
213
 214
214
 215
215
 216
216
 217
217
 218
218
 219
219
 220
220
 221
221
 222
222
 223
223
 224
224
 225
225
 226
226
 227
227
 228
228
 229
229
 230
230
 231
231
 232
232
 233
233
 234
234
 235
235
 236
236
 237
237
 238
238
 239
239
 240
240
 241
241
 242
242
 243
243
 244
244
 245
245
 246
246
 247
247
 248
248
 249
249
 250
250
 251
251
 252
252
 253
253
 254
254
 255
255
 256
256
 257
257
 258
258
 259
259
 260
260
 261
261
 262
262
 263
263
 264
264
 265
265
 266
266
 267
267
 268
268
 269
269
 270
270
 271
271
 272
272
 273
273
 274
274
 275
275
 276
276
 277
277
 278
278
 279
279
 280
280
 281
281
 282
282
 283
283
 284
284
 285
285
 286
286
 287
287
 288
288
 289
289
 290
290
 291
291
 292
292
 293
293
 294
294
 295
295
 296
296
 297
297
 298
298
 299
299
 300
300
 301
301
 302
302
 303
303
1
/
303
100%