diaporama

Le tableau périodique
I. Historique
a) construction
b) la classification
actuelle
c) conséquence
II. La famille des métaux
alcalins
a) situation
b) propriétés physiques
c) propriétés chimiques
III. La famille des
halogènes
a) Situation
b) Propriétés physiques
c) Propriétés chimiques
IV. La famille des gaz
nobles
a) Situation
b) Propriétés physiques
c) Propriétés chimiques

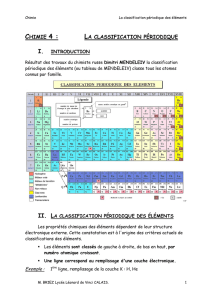
a) Construction historique
Le tableau périodique a été
construits par Mendéléïev (1862)
- En rangeant les éléments par ordre
de masse croissante
- En regroupant les éléments
chimiques ayant des propriétés
chimiques semblables en famille
chimique

b) La classification actuelle
•basée sur la structure électronique
des éléments

c) conséquence
•la classification actuelle et la
classification historique sont
concordantes
•Il y a donc un lien entre les propriétés
chimiques d’un éléments et sa
structure électronique externe
•Les propriétés chimiques d’une famille
chimique dépendent de la structure
électronique externe

II. Les métaux alcalins
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%