CHAPITRE 1 :

Chimie La classification périodique des éléments
M. BRIEZ Lycée Léonard de Vinci CALAIS.
1
CHIMIE 4 : LA CLASSIFICATION PÉRIODIQUE
I. INTRODUCTION
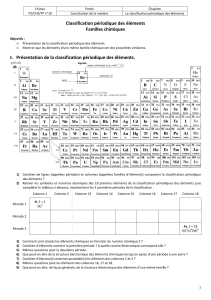
Résultat des travaux du chimiste russe Dimitri MENDELEIV la classification
périodique des éléments (ou tableau de MENDELEIV) classe tous les atomes
connus par famille.
II. LA CLASSIFICATION PÉRIODIQUE DES ÉLÉMENTS
Les propriétés chimiques des éléments dépendent de leur structure
électronique externe. Cette constatation est à l'origine des critères actuels de
classifications des éléments.
Les éléments sont classés de gauche à droite, de bas en haut, par
numéro atomique croissant.
Une ligne correspond au remplissage d'une couche électronique.
Exemple :
1ère ligne, remplissage de la couche K : H, He

Chimie La classification périodique des éléments
M. BRIEZ Lycée Léonard de Vinci CALAIS.
2
2ème ligne, remplissage de la couche L : Li, Be, B, C, N, O, F, Ne.
…
Les éléments d'une même colonne (également appelée période) ont
la même structure électronique externe (C'est à dire qu'il on le même
nombre d'électrons sur leur couche externe) donc des propriétés
chimiques voisines.
III. LES FAMILLES D'ÉLÉMENTS
Dans une même colonne se trouve regroupés des éléments aux propriétés
chimiques analogues. Ils ont la même structure électronique externe :
Colonne 1 (à l'exception de l'hydrogène) : les métaux alcalins
Colonne 2 : métaux alcalino-terreux
Colonne 3 à 12 : métaux de transition
Colonne 17 : halogènes
Colonne 18 : gaz rares ou nobles.
IV. UTILISATION DE LA CLASSIFICATION PÉRIODIQUE
1 RETROUVER LA CHARGE DES IONS MONOATOMIQUES
L'atome acquiert la charge qui lui permet d'avoir la structure
électronique du gaz rare le plus proche.
Exemple :
F gagne un électron pour former F- (structure électronique de Ne)
Na perd un électron pour former Na+ (structure électronique de Ne)
De façon générale, tous les alcalins forment un ion positif (Li+, Na+, K+), tous les
halogènes forment un ion négatif (F-, Cl-, Br-, I-) et les alcalino-terreux forment
un cation qui porte deux charges positives (Be2+, Mg2+ …).
2 RETROUVER LE NOMBRE DE LIAISON QUE PEUT
ÉTABLIR UN ÉLÉMENT
Par exemple, l'application de la règle de l'octet permet de prédire que
l'atome d'azote (colonne 15) avec 5 électrons sur sa couche externe peut
engager 3 liaisons (sa valence est 3).
1
/
2
100%