La recherche d`alternance de l`onde T dans la stratification du risque

Fraction d’éjection ventriculaire gauche et/ou test d’alternance de l’onde T dans la
stratification du risque de mort subite dans les cardiopathies ischémiques et
nonischémiques : comment mieux sélectionner les patients candidats à une
implantation de défibrillateur interne en prévention primaire ?
Dr Antoine de Meester. Hôpital de Jolimont. 7100 Haine Saint Paul
Le problème de la mort subite (SCD : sudden cardiac death)
La mort subite cardiaque est un problème majeur de santé publique (1-2); elle représente aux
USA environ 450.000 cas par an, soit 1200 par jour, 50 par heure ou une mort subite toutes les
80 secondes. Elle représente plus de décès que la mortalité réunie des pathologies classiques :
AVC (170.000 décès par an), cancer du poumon (160.000 décès par an), cancer du sein (40.000
décès par an) ou SIDA (42.000 décès par an). Des études avec autopsie montrent deux groupes
de victimes de mort subite avec cardiopathie ischémique : 2/3 des cas présentent une
athéromatose coronaire avec rupture/érosion de plaque récente, résultant en une thrombose aiguë
(= ischémie/infarctus aigu) ; le second groupe (1/3 des cas) a manifestement souffert d’un ancien
infarctus du myocarde, avec une nécrose (ou substrat arythmogène) évident. La combinaison des
deux est possible. La présence assez fréquente d’une hypertrophie ventriculaire gauche est
observée. L’arrêt cardiaque est la première manifestation de la maladie coronaire dans 50% des
cas ; les patients ont le plus souvent une maladie d’un vaisseau et une fraction d’éjection
ventriculaire gauche (FEVG) normale ; seuls 10% des victimes de mort subite ont une
dysfonction cardiaque nette, bien que ce paramètre soit un facteur majeur de mauvais pronostic.
Les données pathologiques et épidémiologiques montrent donc clairement la possibilité de deux
modèles de mort subite : un groupe avec ischémie/infarctus aigu et FEVG plus ou moins
conservée, et l’autre composé de patients avec antécédents d’infarctus du myocarde et
possible/probable dysfonction cardiaque.
La mort subite cardiaque est due dans 80% des cas à une arythmie de type tachycardie
ventriculaire (TV) ou fibrillation ventriculaire (FV). Moins de 5% des patients vont survivre si la
mort subite cardiaque est objectivée hors de l’hôpital ; la présence d’un témoin sur place qui
débute une réanimation active est capitale, car en son absence les chances de survie diminuent de
7-10% par minute sans réanimation. Par la suite, les survivants ont un risque de décès de 40%
endéans les 2 ans. La prévention (… de la maladie coronarienne, …) est donc un élément capital.
Depuis le concept de Myerburg, publié dans Circulation en 1998, nous savons qu’il existe des
sous-groupes à faible et haut risque de mort subite cardiaque (3). De plus, il y a une relation
inverse entre l’incidence de mort subite cardiaque dans un groupe (% de décès par an) et le
nombre total de décès dans ce groupe (n total de décès). Dans la population générale, le risque de
décès est de moins de 1% par an, et par contre, et c’est dans ce groupe que le nombre total de
mort subite cardiaque est le plus élevé.
Les défibrillateurs implantables (ICD)
De nombreuses études ont évalué le bénéfice de mise en place d’un défibrillateur implantable
(ICD : implantable cardioverter defibrillator) dans les groupes à risque de mort subite cardiaque
en prévention secondaire (Etudes AVID, CIDS, CASH) puis prévention primaire (Etudes
MADIT, MUSTT, MADIT-II, DINAMIT, SCD-HeFT) (4-15). Le Tableau I montre les études

avec diminution de la mortalité totale dans les groupes de patients porteurs de défibrillateurs en
prévention primaire de mort subite.
Actuellement, les guidelines recommandent donc l’implantation d’un défibrillateur implantable
pour tout patient avec dysfonction cardiaque (fraction d’éjection ventriculaire gauche FEVG ≤
35%) secondaire à un infarctus du myocarde de plus d’un mois ou une cardiomyopathie
nonischémique, sous traitement médical optimal de plus de 3 mois. Ces recommandations sont
basées sur la relation fondamentale entre une FEVG basse et la mortalité dans les études
MADIT-II et SCD-HeFT (11-13).
Problèmes de stratification du risque de mort subite avec la seule diminution de FEVG !
Il existe des limitations évidentes pour que la FEVG soit le (seul) idéal test pour la prise de
décision d’implanter un défibrillateur en prévention primaire de mort subite cardiaque (16).
· Le premier problème vient de la technique de détermination de la FEVG.
L’échocardiographie reste la méthode la plus aisée à faire, mais sans beaucoup de
reproductibilité inter- et intra-observateur ; … elle est donc totalement dépendante de
l’opérateur. Les techniques de ventriculographie isotopique ou angiographique ont les mêmes
problèmes. L’évaluation de la FEVG par résonance magnétique nucléaire (RMN) est
aujourd’hui équivalente à l’échocardiographie.
· Le registre de Maastricht et l’étude française ATRAMI ont montré que plus de 50% des
morts subites cardiaques surviennent chez des patients avec une FEVG > 35% (17-18)
· Dans les études classiques (MADIT I-II, MUSTT, SCD-HeFT), la FEVG moyenne est de
25%, ce qui est nettement moins que les 35% retenus pour un bénéfice net du défibrillateur ;
dans l’étude MADIT II, la mise en place d’un défibrillateur ne diminuait pas la mortalité
totale dans le sous groupe avec FEVG de 26-35%, contrairement au groupe avec FEVG ≤
25% (11-16).
· Le bénéfice d’un défibrillateur implantable est strictement lié à cinq variables cliniques : âge
> 70 ans, classe fonctionnelle NYHA > 2, insuffisance rénale avec BUN > 26, durée du QRS
> 120 msec, ou présence de fibrillation auriculaire. Goldenberg a démontré l’absence de
bénéfice du défibrillateur en l’absence (score = 0/5) ou, par contre, en présence de plus de
deux de ces facteurs cliniques (score ≥ 2/5) (19).
· Buxton a également montré que certaines variables (âge, classe fonctionnelle NYHA,
présence de TV non soutenue ou de fibrillation auriculaire, ..) avaient un impact pronostic
majeur sur la mortalité totale ou rythmique chez les patients de l’étude MUSTT (20). Le
modèle démontrait, par exemple, que les patients avec seulement une FEVG ≤ 30% avaient
un risque de décès rythmique à 2 ans de moins de 5% ; un autre patient en décompensation
cardiaque, avec FEVG > 35%, et avec TV non soutenue spontanée et soutenue lors d’un
examen électrophysiologique avait un risque de décès rythmique de 10%.
· Les patients qui bénéficient le plus d’un défibrillateur implantable en prévention primaire de
mort subite cardiaque sont ceux avec une stratégie de stratification du risque combiné (pex
dans MADIT : FEVG + examen électrophysiologique; diminution de décès par an =10% ;
AVID 4%, MADIT2 3%, SCD-HeFT 2%). Le nombre de patient à traiter (NNT) pour éviter
un décès est résumé au tableau II.
· Notons enfin que la FEVG doit être évaluée au moins 30-40 jours après infarctus du
myocarde (DINAMIT) ou à distance d’une revascularisation (CABG-Patch), mais que le
bénéfice d’un défibrillateur reste identique si la FEVG est ≤ 30% même 10 années après
infarctus du myocarde (MADIT-II) (1, 4, 12).
Autres examens complémentaires dans la stratification du risque de mort subite cardiaque

Le lien entre induction d’une TV soutenue, lors d’un examen électrophysiologique (EEP), et
mort subite est étudié depuis longtemps. L’EEP, examen invasif, permettant de confirmer la
nature physiopathologique réentrante des TV ischémiques (et donc la présence d’un substrat
arythmogène), peut donc être utile comme démontré dans les études MADIT et MUSTT ;
l’association avec une dysfonction VG ou de présence d’alternance de l’onde T (Etude ABCD)
augmente la valeur prédictive de risque de mort subite de ce test. L’intérêt de l’EEP est bien
moins clair pour les patients souffrants de cardiomyopathie nonischémique.
Beaucoup de marqueurs noninvasifs (Holter, BRS, HRV, SAECG, …) ont aussi été étudiés dans
des études prospectives (2); l’étude CARISMA montre le bénéfice de la recherche de la
variabilité sinusale (HRV). L’étude REFINE, par contre, confirme le risque d’événements
sérieux en présence d’une alternance de l’onde T et de dysfonction du tonus autonomique (22).
Dans l’étude ISAR-RISK, la présence d’une défaillance du système nerveux autonomique est
aussi un facteur de risqué majeur de mort subite cardiaque.
L’alternance de l’onde T (TWA : T-wave alternans) est, depuis quelques années, considéré
comme un marqueur noninvasif prometteur et significatif de mort subite (2, 23-26) ; elle est
directement liée au substrat électrophysiologique et au mécanisme cellulaire pour les arythmies
malignes. L’apparition de TWA est probablement due à une alternance localisée du potentiel
d’action, associé à une durée de repolarisation prolongée, et donc une dispersion de la
repolarisation, pouvant entraîner des blocs unidirectionnels et les circuits myocardiques
arythmogènes. L’alternance de l’onde T est définie comme la variation de la morphologie
(amplitude et forme) de l’onde T (battement par battement) lors d’un examen d’effort (pour une
fréquence cardiaque entre 100-120 bpm); l’examen, d’une durée moyenne de 20-30 minutes, doit
se réaliser en rythme sinusal, en l’absence de prise de β-bloquants. Il inclut une préparation
cutanée attentive, avec abrasion locale et mise en place d’électrodes spéciales de haute résolution
afin d’éviter toute interférence de parasites (analyse du signal en microvolts). L’épreuve d’effort
sur cycloergomètre (ou tapis roulant) est faite pour atteindre deux paliers de fréquence cardiaque,
le premier entre 100-110 bpm pendant 2.5 minutes et le deuxième pour une fréquence de 110-
120 bpm pendant 1.5 minute. Le résultat est traité directement par un programme (Heartwave II,
Cambridge Heart Inc., Bedfort, MA, USA) avec enregistrement du signal, filtration du bruit de
fond et analyse spectrale ; celle-ci se fait soit au niveau des dérivations précordiales (V1-V6) soit
des dérivations orthogonales (X-Y-Z) (Figure 1). Le test est positif en présence d’alternance
soutenue de l’onde T > 1.9 microvolts lors de fréquences cardiaques seuils ≤ 110 bpm. Le test est
négatif lorsque le critère TWA n’est pas rempli pour une fréquence cardiaque négative maximale
≥ 105 bpm. Le test est indéterminé dans les autres cas, surtout en présence de parasites,
fréquence cardiaque inadéquate, nombreuses extrasystoles, … . La plupart des études comparent
un test négatif (TWA-) et non-négatif (positif ou intermédiaire).
Les études de recherche d’alternance de l’onde T sont résumées au tableau III (21, 26-36). La
plupart de celles-ci confirment que le test est globalement efficace pour prédire le risque
d’arythmies ventriculaires malignes chez des patients implantés ou non d’un défibrillateur pour
prévention primaire de mort subite. L’étude MASTER est quasiment la seule à démontrer que le
test est inapte à dépister les sujets à risque de mort subite ; il existe cependant une mortalité
extracardiaque inhabituelle dans le groupe avec test négatif (37). Le test peut être le
complément d’un examen électrophysiologique comme démontré dans l’étude ABCD ; Amit
identifie que ces deux tests (TWA et EEP) mesurent différents éléments du substrat
arythmogène, en prédisant la survenue d’arythmies distinctes : l’alternance de l’onde T pour des
arythmies ventriculaires instables (TV polymorphes ou FV) et l’EEP pour une TV monomorphe
stable (21, 38). Notons d’office que la valeur prédictive négative du test est très importante

(pas/peu d’évènements si le test est négatif) ; dans ces cas, il n’y a aucune évidence du bénéfice
d’implanter un ICD en prévention primaire (23).
Notre groupe a présenté, lors du dernier congrès de la société belge de cardiologie, en janvier
2010, les résultats d’une étude prospective réalisée à Jolimont ; 73 patients (âge 60.4 ± 9.4 ans,
85% d’hommes, 75% de cardiomyopathies ischémiques, et FEVG moyenne 30.6 ± 5.2%) ont été
inclus (39). Lors du suivi, 26 patients ont eu l’implantation d’un ICD (35.6%) à la discrétion du
cardiologue. La survenue d’arythmie (TV/ FV) ou de mort subite, défini comme un décès
soudain inexpliqué, est examiné lors du suivi de ± 3 ans. Un test TWA anormal ou non-négatif
(positif ou intermédiaire) est associé avec un risque significatif d’évènements cardiaques, avec
une haute sensibilité (84.6% and 77.7%) et valeur prédictive négative (95.5% and 95.5%) pour
des arythmies documentées TV/FV ou mort subite respectivement. Le sous-groupe avec TWA
normal semble donc avoir un très bon pronostic à long-terme.
Rappelons qu’il existe une restriction de mise en place de défibrillateur, en Belgique, imposée
par l’INAMI.; celle-ci impose aux centres cardiologiques un maximum de 40 % d’implantations
de ICD en prévention primaire par rapport au total d’ICD implantés ; la possibilité d’une liste
d’attente du placement d’un ICD pour quelques patients existe réellement. Le KCE (Belgian
Health Care Knowledge Centre (KCE), institution « semi » gouvernementale avait en 2007
donné un avis assez défavorable sur le rapport coût-efficacité des ICD en prévention primaire,
alors que le remboursement dans ces indications n’était pas encore possible en Belgique (KCE
reports 58B) (40). Beaucoup de paramètres n’ont pas été pris en compte dont la durée du follow-
up et le NNT (Number Needed to Treat) par rapport à d’autres procédures ou traitements.
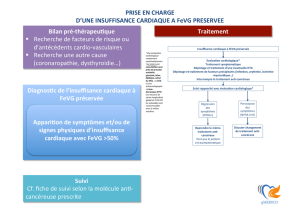
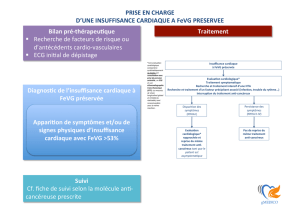
Vu cette restriction INAMI, le résultat de cette étude à Jolimont, et des autres études (dont
MADIT-II), un algorithme clinique est proposé sur base du test d’alternance de l’onde T pour la
prise en charge des patients à risque en prévention primaire de mort subite, après avoir adapté
celui d’Hohnloser (23) (figure 2). La valeur prédictive négative importante du test TWA permet
ce concept, mais à confirmer dans des prochaines études prospectives.
En conclusion, la mort subite cardiaque reste un évènement dramatique ; la première prévention
est celle des facteurs de risque coronaire (tabac, HTA, hypercholestérolémie, diabète, …) et ainsi
d’éviter la survenue d’un infarctus aigu du myocarde. Un traitement optimal médicamenteux est
ensuite requis (aspirine, clopidogrel, beta-bloquants, IEC/sartan, et statine). Un bilan à distance
est ensuite nécessaire, avec surtout évaluation de la FVEG. Actuellement, les guidelines
recommandent donc l’implantation d’un ICD pour tout patient avec FEVG ≤ 35%, secondaire à
un infarctus du myocarde de plus d’un mois ou une cardiomyopathie nonischémique, sous
traitement médical optimal de plus de 3 mois. Sachant que la FEVG, n’est pas le test idéal, il
semble que d’autres examens noninvasifs, dont l’alternance de l’onde T, ont leur place pour
mieux discriminer le risque réel de mort subite et la décision de mise en place du ICD en
prévention primaire. Le coût d’un tel traitement nous oblige à réfléchir pour l’avenir.

Références
1. Huikuri HV, Castellanos A, Myerburg RJ. Sudden death due to cardiac arrhythmias. N Engl J
Med, Vol. 345, 1774 -82
2. Buxton AE. Risk stratification for sudden death in patients with coronary artery disease.
Contemporary review. Heart Rhythm 2009; 6: 836-47.
3. Myerburg RJ, Mitrani R, Interian A Jr, Castellanos A. Interpretation of outcomes of
antiarrhythmic clinical trials: Design features and population impact. Circulation
1998;97:1514-1521.
4. Myerburg RJ. Implantable Cardioverter–Defibrillators after Myocardial Infarction. N Engl J
Med 2008; 359: 2245-53.
5. The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. A comparison
of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from
near-fatal ventricular arrhythmias. N Engl J Med 1997; 337: 1576-83
6. Connolly SJ, Gent M, Roberts RS, et al. Canadian Implantable Defibrillator Study (CIDS): a
randomized trial of the implantablecardioverter defibrillator against amiodarone. Circulation
2000; 101: 1297-302.
7. Kuck KH, Cappato R, Siebels J, RüppelR. Randomized comparison of antiarrhythmic drug
therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the
Cardiac Arrest Study Hamburg (CASH). Circulation 2000; 102: 748-54.
8. Connolly SJ, Hallstrom AP, Cappato R, et al. Meta-analysis of the implantable cardioverter
defibrillator secondary prevention trials. AVID, CASH and CIDS studies. Antiarrhythmics vs
implantable defibrillator study. Cardiac Arrest Study Hamburg. Canadian Implantable
Defibrillator Study. Eur Heart J 2000; 21: 2071e8.
9. Moss AJ, Hall WJ, Cannom DS, et al. Improved survival with an implanted defibrillator in
patients with coronary disease at high risk for ventricular arrhythmia (MADIT). N Engl J
Med 1996; 335: 1933-40.
10. Buxton AE, Lee KL, Fisher JD, et al. For the the Multicenter Unsustained Tachycardia Trial
Investigators (MUSTT). A randomized study of the prevention of sudden death in patients
with coronary artery disease. N Engl J Med 1999; 341:1882-90.
11. Moss AJ, Zareba W, Hall WJ, et al. Prophylactic implantation of a defibrillator in patients
with myocardial infarction and reduced ejection fraction (MADIT-II). N Engl JMed 2002;
346: 877-83.
12. Hohnloser, SH, Kuck, KH, Dorian, P, et al. (DINAMIT). Prophylactic use of an implantable
cardioverter-defibrillator after acute myocardial infarction. N Engl J Med 2004; 351: 2481-8.
13. Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an implantable cardioverter–defibrillator
for congestive heart failure (SCD-HeFT). N Engl J Med 2005; 352: 225-37.[Erratum, N Engl
J Med 2005; 352: 2146.]
14. Kadish, A, Dyer, A, Daubert, JP, et al. for the Defibrillators in Non-Ischemic
Cardiomyopathy Treatment Evaluation (DEFINITE) Investigators. Prophylactic defibrillator
implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med 2004; 350:
2151-8.
15. Bristow, MR, Saxon, LA, Boehmer, J, et al. (COMPANION). Cardiac-resynchronization
therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl
J Med 2004; 350: 2140-50.
16. Buxton AE. Should everyone with an ejection fraction less than or equal to 30% receive an
implantable cardioverter-defibrillator? Not everyone with an ejection fraction ≤ 30% should
receive an implantable cardioverter-defibrillator. Circulation 2005; 111: 2537–2549.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%