Chimie organique

Collège Voltaire / 4CH / Chimie organique / 2016-2017
AIDE-MÉMOIRE
Chimie
organique
http://dcpe.net/POII/sites/default/files/cours%20et%20ex/cours-ch4-organique.pdf
Table des matières
1.A.Introduction.......................................................................................3
1.B.Cycle du carbone................................................................................4
1.B.1.Origine du carbone organique....................................................................4
1.B.2.Du carbone minéral au carbone organique..................................................4
1.B.3.Du carbone organique au carbone minéral..................................................5
1.B.4.Le pétrole................................................................................................5
1.C.Formules chimiques............................................................................7
1.C.1.Notation..................................................................................................7
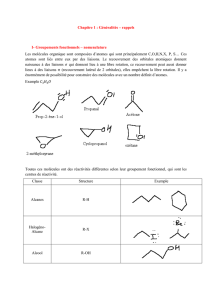
1.C.2.Groupes fonctionnels................................................................................9
1.C.3.Nomenclature.........................................................................................10
1.C.3.1. Hydrocarbures............................................................................................10
1.C.3.2. Groupes Fonctionnels..................................................................................13
1.D.Isomérie..........................................................................................15
1.D.1.Isomère de conformation........................................................................15
1.D.2.Isomère de configuration.........................................................................16
1.D.2.1. Isomère de position....................................................................................16
1.D.2.2. Isomère de structure...................................................................................16
1.D.2.3. Isomère géométrique..................................................................................16
1.D.2.4. Isomère optique.........................................................................................17
1.D.3.Résumé (isomérie).................................................................................19

Aide-mémoire
1.E.Les orbitales.....................................................................................21
1.E.1.Introduction...........................................................................................21
1.E.2.Orbitale atomique...................................................................................22
1.E.2.1. Géométrie des orbitales atomiques...............................................................22
1.E.2.2. Principes d’occupation des orbitales atomiques...............................................22
1.E.2.3. Hybridation sp3, sp2 et sp.............................................................................23
1.E.3.Orbitales moléculaires.............................................................................24
1.E.3.1. Liaison sigma (σ)........................................................................................24
1.E.3.2. Liaison pi (Π)..............................................................................................24
1.F.Effets électroniques...........................................................................26
1.F.1.Effet inductif...........................................................................................26
1.F.2.Effet de résonance...................................................................................26
1.F.2.1Hybridation par résonance..............................................................................27
.....................................................................................................27
1.F.2.2Formes limites de résonance...........................................................................28
1.F.2.3La stabilité des formes limites de résonance.....................................................30
1.G. Solubilité........................................................................................31
1.G.1.Liaison hydrogène..................................................................................31
1.G.2.Les savons et la saponification.................................................................32
1.H.Acides et bases de Lewis...................................................................33
1.I.Mécanismes réactionnels....................................................................34
1.I.1.Définitions..............................................................................................34
1.I.2.Types de réaction....................................................................................34
1.I.3.Substitution nucléophile...........................................................................35
1.I.3.1Substitution nucléophile bimoléculaire (SN2).....................................................36
1.I.3.2Substitution nucléophile unimoléculaire (SN1)...................................................37
1.I.4.Substitution électrophile..........................................................................38
1.I.5.Réaction de Grignard...............................................................................39
1.I.6.Addition..................................................................................................40
1.I.7.Polymérisation........................................................................................41
1.I.8.Estérification et hydrolyse........................................................................43
1.I.9.Résumé : réaction et mécanisme..............................................................44
p.
2

Aide-mémoire
1.A. Introduction
Traditionnellement, la chimie est divisée en deux grandes catégories que sont la chimie minérale
et la chimie organique. Etymologiquement, la chimie minérale étudie les substances provenant du
monde inanimé et la chimie organique, celles qui proviennent des organismes vivants.
L'homme utilisait et utilise encore de nombreux mélanges de substances organiques naturelles
comme les parfums, certains médicaments, des essences, du bitume. Mais dès la fin du XIème
siècle, il commence à isoler des corps purs :
-XI ème siècle : éthanol (alcool issu de la fermentation)
-en 1747 : saccharose (sucre de betterave)
- en 1773 : urée
Cette distinction était imprégnée d'idées philosophiques, puisque, jusque en 1842, date à laquelle
Friedrich Wöhler synthétisa l'urée, de nombreux chimistes pensaient que seuls les êtres vivants
étaient capables de produire des molécules organiques grâce à une
force vitale
inaccessible à la
science. Aujourd'hui, le terme de chimie organique signifie chimie des composés du carbone à
l’exception de ses oxydes (CO et CO2), de l’acide carbonique (H2CO3), des carbonates (CO32- ), des
cyanures (CN-) et des carbures(C22-). La chimie des substances du monde vivant s'appelant, plus
spécifiquement, chimie biologique ou biochimie.
Depuis cette date l'homme a synthétisé des millions de molécules organiques, les unes,
identiques à celles que l'on trouve dans la nature, d'autres n'ayant rien à voir avec le monde
vivant. Nombre de composés connus :
- en 1880, 12 000 - en 1910, 150 000
-en 1940, 500 000 -en 1960, 1 000 000
Les molécules organiques ont diverses applications dans la vie courante, par exemple :
-en 1929, Sagex (polystyrène expansé)
-en 1938, Teflon
- en 1939, DDT (insecticide)
- en 1940, Nylon
- en 1966, Insuline etc.
La plus petite molécule organique est le méthane CH4 et les plus grosses des polymères comme
les protéines de poids moléculaire largement supérieur à 1000.Les composés organiques
contiennent, en général, de nombreux atomes de carbone, ces derniers étant liés entre eux et
formant de longues chaînes, parfois ramifiées. Cette particularité est typique de l'élément
carbone; elle n'est que partiellement partagée par le silicium. C'est ainsi que toute forme de vie
qui a pu apparaître dans l'univers ne peut être basée que sur des composés carbonés, qui seuls
peuvent procurer une telle diversité de molécules.
Distinctions entre composés minéraux et organiques
Composés minéraux Composés organiques
Ils ne contiennent pas de carbone, à l’exception
de ses oxydes (CO et CO2), de l’acide carbonique
(H2CO3), des carbonates (CO32- ), des cyanures
(CN-) et des carbures(C22-)
Ils sont surtout constitués de carbone, hydrogène,
oxygène et peuvent contenir d'autres éléments comme
l'azote, le soufre, le phosphore, etc.
Formés de liaisons ioniques ou à caractère
ionique marqué. Formés de liaisons covalentes.
Solubles dans l'eau. Rarement solubles dans l'eau.
Très stables thermiquement. Facilement décomposés par la chaleur
Rarement combustibles. Presque tous combustibles.
p.
3

Aide-mémoire
1.B. Cycle du carbone
http://abdelkader.saim.free.fr/2nde/P1C3/schema_cycle_carbone_correction.GIF
1.B.1. Origine du carbone organique
La formation de composés organiques est donc une particularité du monde vivant. L’origine du
carbone est le dioxyde de carbone (CO2) atmosphérique qui constitue une réserve de carbone
minéral. Ainsi, chaque année, environ le tiers du CO2 atmosphérique est utilisée dans ce qu’on
appelle le cycle du carbone.
1.B.2. Du carbone minéral au carbone organique
a)
La photosynthèse
Les végétaux verts (chlorophylle) trouvent leur carbone en puisant directement dans les
réserves de gaz carbonique de l’atmosphère. La photosynthèse permet aux plantes d’utiliser
le carbone minéral et le faire passer à l’état de molécules organiques. La lumière du soleil
fournit l’énergie nécessaire à la réaction.
6 CO2 + 6 H2O C→6H12O6 + 6 O2
(atmosphère) (sol) (glucose) (atmosphère)
Le glucose, formé sert de matière première à toutes les synthèses effectuées à l’intérieur
de la plante. Ainsi, à la surface du globe, 150 milliards de tonnes de carbone sont introduites
par photosynthèse dans des molécules organiques.
b)
La chaîne alimentaire
Les animaux et les végétaux non verts (champignons), ainsi qu’un grand nombre de bactéries
s’alimentent aux dépends des végétaux verts. Par exemple, les herbivores consomment des
plantes et les carnassiers mangent les animaux herbivores.
Ils n’utilisent pas les molécules organiques telles qu’ils les ont trouvées, mais les
transforment par digestion en molécules plus simples que leurs cellules assimilent, puis
assemblent en composés plus spécifiques.
p.
4

Aide-mémoire
1.B.3. Du carbone organique au carbone minéral
a)
La respiration des êtres vivants
La respiration des animaux et végétaux libère du CO2 en même temps qu’elle absorbe de
l’oxygène de l’atmosphère. Une part importante du carbone fixé par le mode vivant retourne
ainsi à la réserve commune.
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
b)
Les décompositions
Les plantes et animaux morts libèrent du CO2 produit par les bactéries et les moisissures qui
les décomposent. Celles-ci se font souvent par fermentation (soit par transformation de ces
substances organiques sous l’influence d’enzymes produits par des microorganismes). La
fermentation de solutions sucrées par exemple produit de l’alcool, de l’eau et du gaz
carbonique tandis que la fermentation putride de protides produit de l’ammoniac et du gaz
carbonique.
Exemple : Fermentation alcoolique
C6H12O6 → 2 CH3CH2OH + 2 H2O + 2 CO2
c)
Les combustions
La combustion des molécules contenant du carbone est la principale source d’énergie
actuellement dans le monde.
Exemple : Combustion complète de l’essence (par approximation C8H18)
2 C8H18 + 25 O2 16 CO→2 + 18 H2O
Combustion incomplète de l’essence
2 C8H18 + 17 O2 16 CO + 18 H→2O
2 C8H18 + 9 O2 16 C + 18 H→2O
1.B.4. Le pétrole
Le pétrole, combustible fossile, s'est formé depuis des centaines de millions d'années par
l'action conjuguée de microorganismes anaérobies, de la température et de la pression sur les
déchets organiques marins. Le pétrole qui est resté emprisonné dans des roches imperméables
est celui qui nous est accessible aujourd'hui. Le bitume était déjà connu des Assyriens.
Schéma d'un gisement
Le pétrole est un mélange
d'hydrocarbures, des molécules ne
contenant que de l'hydrogène et du
carbone, de formes et de dimensions
variées. Il peut également contenir
quelques composés soufrés. Les
hydrocarbures du pétrole sont
surtout des alcanes (molécules avec
des liaisons simples). La composition
d'un pétrole change selon son lieu
d'extraction. Les grandes classes de
composés sont les hydrocarbures en
chaînes droites, en chaînes ramifiées,
cycliques et aromatiques.
p.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
1
/
44
100%