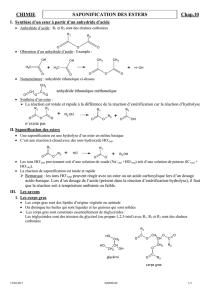
I. La réaction de saponification d`un Ester (******) 1) Rappel

T ST2S Pôle Chimie
Chapitre chimie N°8 :
Les savons
I. La réaction de saponification d’un Ester (******)
• La réaction qui permet de fabriquer un savon est une réaction de saponification.
1) Rappel : Réaction d’hydrolyse d’un ester
• L’hydrolyse d’un ester est la réaction entre un ester et l’eau.
• C’est une réaction………………………….. et ……………………………
2) Définition : Réaction de saponification
• Les produits de la saponification sont : …………………………………………………………………………………………………………………
Remarque
L’ion hydroxyde de formule OH
-
provient de la soude {Na
+
,OH
-
} ou de la potasse {K
+
,OH
-
}
3) Exemple : Saponification du butanoate d’éthyle
II. Saponification d’un corps gras : Synthèse d’un savon
1) Rappel : Corps gras
• Les corps gras sont des triesters provenant de la réaction :
d’acide gras (acide carboxylique) avec le glycérol.
• On les appelle aussi des triglycérides. (formés par une réaction d’Estérification)
Définition de la Saponification
(******)
Réaction de Saponification (******)
Triglycérides
Page 1 / 6

T ST2S Pôle Chimie
Rappel : Formation d’un corps gras ( Triglycérides ou triesters)
2) Saponification d’un triglycéride ( Ou Hydrolyse basique d’un triester) (******)
a) Cas général
La saponification d’un triglycéride par la soude {Na
+
,OH
-
} aboutit à la formation de :
…………………………………………………………
……………………………………………………………
Remarque ( ***)
Il faut
3 moles
d’ions hydroxyde OH
-
pour 1 mole de triglycéride car c’est un triester.
On obtient ainsi 3 moles d’ions carboxylates, donc 3 moles de savon.
b) Exemples
Enoncé
La palmitine est un triglycéride provenant de la réaction entre :
l’ Acide gras : Acide Palmitique
C
17
H
31
COOH
Le glycérol
Q1/ L’acide Palmitique est-il un acide gras saturé ? Justifier votre réponse.
Q2/ A l’aide de la formule de l’acide Palmitique, donner la formule du triglycéride Palmitine.
Q3/ Ecrire la Réaction de Saponification de la Palmitine.
Page 2 / 6

T ST2S Pôle Chimie
c) Caractéristiques de la réaction : VOIR TP Synthèse d’un savon
• On peut donc définir le rendement de la réaction ŋ
ŋ = n
é
n
′
=n
n
é
Remarque
La réaction étant totale, ŋ =1
Expérimentalement, on a toujours , ŋ <1. Cela s’explique par des pertes au cours de la réaction
.
d) Définition d’un savon (******)
III. Réalisation d’un Savon Voir TP Synthèse d’un savon
A savoir
(****
**)
Page 3 / 6

T ST2S Pôle Chimie
IV. Solubilité des savons
• L’action détergente d’un savon est liée à sa solubilité dans l’eau, c’est à dire à son pouvoir moussant.
a) Solubilité dans l’eau pure.
Lors de la dissolution du savon dans l’eau, les groupes carboxylate et les ions sodium s’entourent de molécules
d’eau et sont dispersés dans la solution : c’est le phénomène de solvatation.
On obtient des ions hydratés. (entourés de molécules d’eau)
Remarque (****)
Les ions carboxylates R-COO
-
rendent l’eau savonneuse basique ( pH>7 ) !!
b) Solubilité dans l’eau acide
• En eau acide, les ions oxonium H
3
0
+
présents réagissent avec les ions carboxylates (savons) pour redonner l’acide
gras correspondant, insoluble dans l’eau
c) Solubilité dans une eau dure
• Une eau dure est une eau riche en ions calcium Ca
2+
et en ions magnésium Mg
2+
Ces ions présents dans les eaux dures
réagissent avec les ions carboxylates pour former des carboxylates de calcium
et magnésium insoluble, réduisant ainsi la quantité de savon soluble, donc efficace pour laver.
R
éaction de
dissolution
d’
un savon
dans l’eau
Réaction du savon dans une
eau acide
Réaction du savon dans une eau dure
Conclusion (****)
Conclusion
(****)
Page 4 / 6

T ST2S Pôle Chimie
d) Solubilité dans une eau salée
• Une eau salée est une solution de chlorure de sodium. (Na
+
,Cl
-
).
Les ions sodium Na
+
réagissent avec les ions carboxylates pour reformer le savon à l’état solide (carboxylate de
sodium ou R—COONa) , ce qui le rend inefficace.
V. Mode d’action des savons
a) Caractère amphiphile de l’ion carboxylate
L’ion carboxylate présente deux propriétés opposées :
• La tête polaire constituée par le groupe carboxylate R-COO
-
Cette tête polaire possède une très grande affinité avec l’eau : Elle est dit ……………………………………………………..
Mais, elle n’a aucune affinité avec les chaînes carbonées R présentent dans les corps gras. : Elle est dit ………………………..
• La queue constituée par la chaîne carbonée : R
Elle « fuit » l’eau. La chaîne carbonée est ………………………………………………………………….
Elle a une très grande affinité pour d’autres chaînes carbonées (corps gras) : elle est ………………………………………
(lipos : graisse)
Conclusion
L’ensemble constitué (tête + chaîne) est dit amphiphiles car la molécule possède deux parties aux propriétés opposées
ce qui confère au savon des propriétés tensioactives.
Réaction du savon dans une eau
salée
Conclusion
(****)
Page 5 / 6
 6
6
1
/
6
100%