Chapitre 12 : Contrôle de l`évolution d`un système

Chapitre 12 : Contrôle de l’évolution d’un système
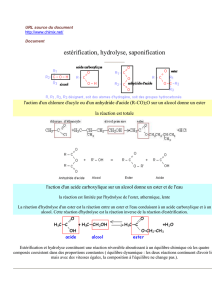
Dans le chapitre précédent, on a vu que la synthèse et l’hydrolyse d’un ester sont des réactions lentes et limitées.
Dans l’industrie, il est donc nécessaire de chauffer, catalyser et déplacer l’équilibre si l’on veut contrôler leur évolution.
Mais peut-on faire autrement ? Peut-on envisager d’autres réactions, d’autres réactifs ?
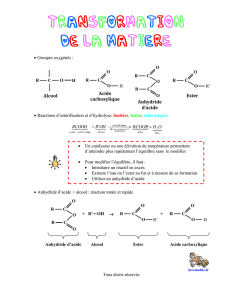
I. SYNTHESE D’UN ESTER A PARTIR D’UN ANHYDRIDE D’ACIDE
1. Les anhydrides d’acide
Ils possèdent le groupe caractéristique – CO – O – CO –
Leur formule générale est : R – CO – O – CO – R’ avec R et R’ qui sont des chaînes carbonées.
Leur nom dérive de (ou des) l’acide(s) carboxylique(s) le constituant(s) en remplaçant « acide » par « anhydride »
Exemples : Anhydride éthanoïque et anhydride éthanoïque méthanoïque
2. Synthèse de l’ester
La réaction envisagée est :
Anhydride d’acide + Alcool = Ester + Acide carboxylique
R – CO – O – CO – R + R’OH = R – COOR’ + R – COOH
Cette réaction est naturellement totale et rapide dans le sens direct.
II. HYDROLYSE D’UN ESTER EN MILIEU BASIQUE
1. La saponification
C’est la réaction à chaud d’un ester avec des ions hydroxyde HO-.
Il se forme un anion carboxylate et un alcool.
Réaction associée : R – COO – R’ + HO- = R – COO- + R’OH
Remarque : les ions hydroxyde sont apportés le plus souvent par une solution de soude (Na++HO-) ou de potasse (K++HO-).
Cette réaction est naturellement totale et rapide dans le sens direct.
2. Conclusion générale
Dans la synthèse ou l’hydrolyse d’un ester, le choix de l’un des réactifs permet de contrôler l’évolution du système chimique en
termes de vitesse et de rendement.
Dans la synthèse, remplacer un acide carboxylique par un anhydride d’acide rend la transformation rapide et totale
Dans l’hydrolyse, remplacer l’eau par HO- rend la transformation rapide et totale.
Dans certains cas, le choix des conditions expérimentales (température, pH, …) permet de privilégier une réaction parmi d’autres
possibles.
III. APPLICATION DE LA SAPONIFICATION : LES SAVONS
1. Les corps gras ou triglycérides
Les huiles (liquides) et les graisses (solides) sont des corps gras. Ils peuvent être d’origine végétale ou animale.
Ce sont des triesters dérivant d’acides carboxyliques appelés acides gras et du glycérol (propan-1,2,3-triol).
R, R’ et R’’ sont des chaînes carbonées qui peuvent être identiques ou différentes.
2. Préparation des savons
Ils sont préparés par saponification des corps gras.
La réaction est la suivante :
Les savons sont des carboxylates de sodium ou de potassium dérivés d’acides gras à longues chaînes carbonées (> 10 C). Ils peuvent
être mous (K+) ou durs (Na+) suivant le cation. Ce sont des bases dans les couples (RCOOH/RCOO-). Un savon est extrait du milieu
réactionnel par relargage : on verse de l’eau salée dans le milieu ce qui diminue la solubilité du savon : il précipite !

3. Propriétés détergentes des savons
Les ions carboxylate constituant le savon comportent deux parties :
- une tête polaire hydrophile – COO- possédant une grande affinité avec l’eau
- une queue apolaire hydrophobe et lipophile – R possédant une grande affinité avec les corps gras
Lorsqu’on prépare de l’eau savonneuse, le savon se solubilise dans l’eau grâce aux propriétés hydrophiles du groupe carboxylate. Les
queues hydrophobes s’orientent alors vers l’air, formant un film de savon en surface, ou les unes vers les autres, formant des
agglomérats d’ions carboxylate appelés micelles en solution.
Si on plonge un textile taché de graisse dans cette eau savonneuse, les queues lipophiles s’orientent vers la graisse et la décollent du
textile. La graisse se retrouve alors piégée dans la solution à l’intérieur de micelles et peut être évacuée dans la phase de rinçage du
textile.
4. Solubilité des savons dans l’eau
Un savon ne mousse pas (n’est pas soluble) dans les eaux dites dures c’est-à-dire contenant des ions calcium et/ou magnésium et/ou
sodium. Son pouvoir détergent est alors fortement diminué.
Dans l’eau salée ou dans les eaux dures, on observe une précipitation du savon.
1
/
2
100%