Prévoir : La synthèse d`un savon

Page 1
Prévoir : La synthèse d’un savon
Matériel :
Tube à essais - Valet liège - Pissette - Hydroxyde de sodium - Chlorure de sodium - Ethanol -
Huile végétale- Huile essentielle de lavande - Eau déminéralisée - Pierre ponce (À réguler
l’ébullition) - Bouchon 1 trou pour adapter le réfrigérant- Chauffe-ballon - Ballon fond rond
250 mL- Tube droit-Eprouvette graduée 50 mL- Agitateur verre- Verre à pied 250 mL-
Spatule – Entonnoir -Erlenmeyer 250 mL- Filtre..
Concentration des solutions :
Solution de soude : c= 10 mol.L-1
Solution de chlorure de sodium : saturée
On peut mouler les petits savons dans des récipients en plastique ayant contenu des petits
« fromages frais », il suffit de faire quelques trous pour évacuer le surplus d’eau et de poser
la coupelle remplie sur un papier absorbant.
Test du savon : on peut prolonger la notion de capacité de nettoyage d’un savon liée à la
dureté de l’eau en faisant réaliser la dissolution d’un morceau de savon dans une eau riche
en ions calcium et magnésium.
Quelques définitions :
1-Corps gras : constituant essentiel des huiles et des graisses d’origine végétale ou animale ,
nombre d’entre eux sont des triglycérides matières premières de la fabrication du savon.
2-Triglycéride est un triester du glycérol et d’un acide gras.
Si cet acide gras est :
l’acide oléique, le triglycéride est le trioléate de glycéryle ou oléine, constituant
principal de l’huile d’olive .
l’acide stéarique, on a affaire au tristéarate de glycéryle ou stéarine (l’un des
constituants des bougies).
l’acide palmitique, le triglycéride est la palmitine (qui a donné son nom à une célèbre
marque de savon) ou tripalmitate de glycéryle.
3-Glycérol est un trialcool : le propane-1, 2, 3-triol de formule semi-développée
CH2(OH)- CH(OH)-CH2(OH).
4-Acide gras est un acide carboxylique à chaîne linéaire, saturée ou non, possédant un

Page 2
nombre pair d’atomes de carbone généralement supérieur à dix. Ils résultent de l’hydrolyse
de triglycérides.
Exemple d’acide gras :
acide stéarique : C17H35C00H
acide oléique : C17H33COOH
Si le nombre est inférieur à 10, ils ont une odeur désagréable tel l’acide butyrique ou
butanoïque à l’odeur de beurre rance !
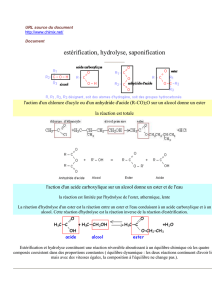
La saponification ou hydrolyse basique :
L’hydrolyse basique, ou saponification, d’un ester est la réaction de l’ion hydroxyde HO-, en
solution concentrée, avec cet ester. Elle donne un alcool et un ion carboxylate selon la
réaction
assez rapide d’équation :
Cette réaction de saponification étant totale, elle est utilisée industriellement pour préparer,
à partir de substances naturelles, des alcools et après acidification du milieu, des acides.
Cependant sa principale application reste la fabrication des savons. Les savons sont obtenus
par saponification d’esters gras, les triglycérides, par l’ion hydroxyde HO- .
1. La réaction est accélérée par élévation de la température. Au laboratoire, on réalise un
chauffage à reflux avec réfrigérant à air (un réfrigérant à eau peut être utilisé).
2. Le corps gras et l’eau ne sont pas miscibles : il est donc nécessaire d’agiter de temps en
temps pendant toute l’expérience pour maintenir les réactifs en contact. De plus,
l’utilisation d’éthanol rend le mélange réactionnel plus homogène, l’eau étant totalement
soluble dans l’éthanol et l’huile partiellement.
3. On recueille le savon par relargage dans une solution d’eau salée saturée. La présence
d’ions sodium diminue la solubilité du savon et facilite sa précipitation.

Page 3
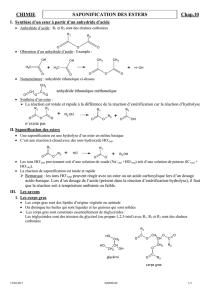
4. La saponification d’un corps gras peut-être réalisée :
Par la soude : on obtient des savons du type « savon de Marseille ».
Par la potasse : on obtient des savons mous : type « savon noir », savon plus doux
utilisés dans les shampooings ou savons liquides.
Cette réaction conduit au glycérol et à un mélange de carboxylate de sodium ou de
potassium : le savon.
Les ions carboxylate R CO2- comprennent deux parties :
un groupe carboxylate CO2 :
chargé négativement, s’entoure très facilement de molécules d’eau polaires : le groupe
carboxylate est hydrophile (du grec hudôr : eau et philos : ami) .En revanche ce groupe n’a
pas d’affinité pour les chaînes carbonées présentes dans les graisses : on dit qu’il est
lipophobe (du grec lipos : graisses et phobos : peur)
un groupe alkyle R :
qui, n’étant pas polaire, n’interagit pas avec les molécules d’eau : il est hydrophobe. En
revanche, la chaîne carbonée a une grande affinité pour les autres chaînes carbonées : le
groupe alkyle est donc lipophile. Donc un ion carboxylate à longue chaîne possède une
partie hydrophile, le groupe CO2- et une partie lipophile, le groupe alkyle R . On dit que
c’est une espèce amphiphile. Ce caractère amphiphile des ions carboxylate présents dans les
savons explique qu’ils puissent former une monocouche à l’interface eau-air, d’où
l’existence des bulles de savon. Il explique aussi la formation d’agrégats, appelés micelles, où
les chaînes carbonées des ions R CO2- se regroupent à l’abri de l’eau.

Page 4
Mode d’action d’un savon :
Le savon est une substance qui permet d’éliminer, par mise en suspension dans les solutions,
des salissures qui adhèrent aux surfaces solides. Certaines salissures d’origine organique
sont moléculaires (huiles végétales, graisses,….), d’autres sont ioniques, c’est le cas des
poussières, de la terre, de la rouille,……………
Les caractères hydrophile et lipophile des savons justifient leur pouvoir nettoyant.
Suivant la nature moléculaire ou ionique de la salissure, l’ion carboxylate interagit avec
celleci, soit par son extrémité lipophile, soit par son extrémité hydrophile. Il se forme ainsi
soit une monocouche, soit une bicouche de savon.
Les expériences montrent que les ions carboxylate à longue chaîne donnent un précipité
avec les ions calcium ou magnésium ; ils perdent alors leurs propriétés nettoyantes. Il ne faut
donc pas utiliser des eaux trop dures avec les lessives.
Il en est de même en eau salée où se reconstituent la molécule de savon qui, non ionisée, ne
lavent plus, ni en eau acide qui favorise la formation de l’acide gras ce qui fait baisser le
nombre des ions carboxylates !
En effet, un savon n’est efficace que par sa dissociation en ions métalliques et en ions
carboxylates afin de mettre en action les extrémités hydrophile et hydrophobe de ces
derniers
En conclusion, un savon qui « mousse bien » lave bien ! On peut ajouter des adjuvants pour
diminuer la dureté de l’eau :
Les polyphosphates : ils réagissent avec les ions calcium et magnésium pour donner
des ions complexes. Ils sont biodégradables mais contribuent au phénomène
d’eutrophisation……
Les agents précipitants : carbonate de sodium, silicates, pyrophosphate de sodium.
Ils précipitent les ions calcium et magnésium.
Mécanisme de la saponification.
Sites électrophiles et nucléophiles
→ L’ion HO- présente un électron en excès.
→ Dans la molécule d’un ester la liaison C= O présente une dissymétrie de répartition de la
charge électronique. L’oxygène est plus électronégatif que le carbone, la liaison C=O est
donc polarisée.
l’atome de carbone du groupe C = O est dit « électrophile » (qui aime les électrons).
Différentes étapes du mécanisme.
Première étape : addition de HO- sur l’ester.

Page 5
Deuxième étape : élimination d’un ion alcoolate.
Troisième étape : réaction acido-basique entre l’acide carboxylique et
l’ion alcoolate.
1
/
5
100%







![ii] exemples de contrôle de l`evolution des systemes](http://s1.studylibfr.com/store/data/001480711_1-aa3c2b78bbfa1ebe201654a385bab67a-300x300.png)
