SYNTHESE D`UN CONSERVATEUR Le E210 1

SYNTHESE D’UN CONSERVATEUR
Le E210
1
But du TP : Synthétiser, extraire une espèce chimique organique, la caractériser et calculer un rendement
I. Le E210
L’acide benzoïque et l’ion benzoate sont des additifs alimentaires surtout utilisé dans les
aliments sucrés. Ils sont utilisés comme conservateurs car ils ont des propriétés fongicides
même à faible dose (propriétés de tuer les champignons microscopiques). Leur code est
composé par la lettre E, qui concerne tous les additifs agroalimentaires suivit d’un nombre :
Ex : E 210 pour l’acide benzoïque.
Cet acide très utilisé dans l’industrie agroalimentaire (boissons gazeuses notamment), est
généralement produit par synthèse à partir du toluène (hydrocarbure aromatique liquide). On
le trouve également à l’état naturel dans des arbustes du genre Styrax (extrême orient) sous
forme d’un baume ou résine appelé Benjoin ou storax
II. Synthèse de l’acide benzoïque
1ère partie : synthèse du benzoate de sodium
Vous réalisez l’oxydation de l’alcool benzylique par le permanganate de
potassium en milieu basique (présence de l’ion carbonate) afin d’obtenir l’ion
benzoate (base conjuguée de l’acide benzoïque). L’acide benzoïque étant très
peu soluble dans l’eau et il est plus facile de synthétiser sa base conjuguée.
a. Introduire dans un ballon les substances suivantes :
2,0 g de carbonate de sodium Na2CO3(s)
100 mL d’eau ;
4,5 g de permanganate de potassium ;
2,5 mL d’alcool benzylique mesuré à l’éprouvette graduée ;
Quelques grains de pierre ponce
b. Mettre le ballon dans un chauffe ballon, et le surmonter d’un réfrigérant.
c. Chauffer à reflux le mélange (maintenez une ébullition douce) environ 20 minutes.
d. Arrêter le chauffage et laisser le ballon se refroidir à l’air quelques minutes.
e. Arrêter la circulation d’eau dans le réfrigérant.
f. Finir de refroidir le ballon sous un courant d’eau froide.
Questions :
1. Légender le schéma.
2. Pourquoi chauffe t’on ?
3. Quel est le rôle du réfrigérant ? Justifier le
terme « à reflux ».
4. Quels sont les couples acido-basique auxquels
appartiennent l’ion carbonate CO32-(aq) provenant
de la dissolution du carbonate de sodium et l’eau.
En déduire l’équation de la réaction acido-basique
entre les ions carbonate et l’eau.
5. Quelle est la classe de l’alcool benzylique et sa
formule brute ?
6. En vous aidant de l’équation de la transformation ci-dessous et à l’aide d’un tableau
d’avancement
OH
Alcool
benzylique

2
Acide
benzoïque
7.
- Montrer que l’alcool est introduit en excès ;
- Exprimer la quantité de matière à l’état final d’ion benzoate formé
en fonction de l’avancement maximal
2ème partie : Extraction de l’ion benzoate
a. Filtrer le mélange réactionnel sous vide à l'aide d'un filtre Büchner. Remarquer le
solide marron (MnO2) formé et retenu dans le filtre Büchner. Jeter le
Relier la fiole à filtration à la trompe à eau ; y adapter l'entonnoir de
Büchner, au fond duquel on place un disque de papier filtre légèrement
imbibé d'eau.
Ouvrir doucement la trompe à eau puis verser progressivement le contenu du
ballon refroidi dans le Büchner de façon à séparer le précipité de dioxyde de
manganèse.
b. Verser le filtrat dans une ampoule à décanter. Ajouter 20 mL de cyclohexane,
agiter et dégazer.
8. Quelles sont les espèces chimiques contenues dans la phase organique ? (Voir données
en fin de TP).
c. Recueillir la phase aqueuse dans un erlenmeyer
3ème partie Cristallisation de l’acide benzoique
a. Réaction acido basique
On acidifie la solution pour faire précipiter l'acide benzoïque
Placer l'erlenmeyer dans un bain de glace.
Ajouter PROGRESSIVEMENT et avec PRÉCAUTION 10 mL
d'acide chlorhydrique concentré, tout en agitant l’erlenmeyer
dans le bain de glace car la réaction est exothermique
(attention aux mousses !).
Vérifier à l'aide d'une touche pratiquée avec l'agitateur sur un papier-pH
que le pH est voisin de 1
Effectuer la filtration sur Büchner du précipité obtenu. Le rincer avec un peu
d'eau froide.
b. L’acide benzoïque a cristallisé.
Essuyer-le le plus possible avec un papier absorbant puis placer le à l’étuve
..........
..La semaine suivante
Mesurer la masse d’acide benzoïque ainsi formé.
9. Tracer le diagramme de prédominance des couples (C6H5COOH/C6H5COO-). Quelle
est alors l'espèce prédominante du couple (C6H5COOH/C6H5COO-) en milieu basique
(pH ≈ 12) ?
10. Écrire l'équation bilan de la réaction entre l'acide chlorhydrique (H3O+ + Cl- ) et l'ion
benzoate C6H5COO-
11. .Calculer la constante d'équilibre K de la réaction (voir données) et montrer que la
réaction est totale.
12. Calculer la quantité puis la masse d'acide benzoïque que l'on aurait obtenu dans le cas
d'une réaction totale sans perte de matière.
C
O
OH

3
13. Etablir l'expression du rendement de la réaction de synthèse de l'acide benzoïque et
le calculer.
14. Ecrire la réaction acido basique entre l’ion benzoate et l’acide chlorhydrique.
15. Calculer la masse théorique d'acide benzoïque que l'on aurait pu obtenir.
16. Calculer le rendement, c'est-à-dire le pourcentage en masse d’acide benzoïque obtenu
expérimentalement par rapport à la masse théorique maximale.
III. Caractérisation CCM
Réaliser la CCM de l’acide synthétisé dans 10 mL d’éluant.
- Dépôt 1 acide benzoïque pur dans l’éthanol
- Dépôt 2 acide benzoïque synthétisé dans l’éthanol
(L’éluant est un mélange de cyclohexane et acétone.)
Révéler sous UV
17. Conclure
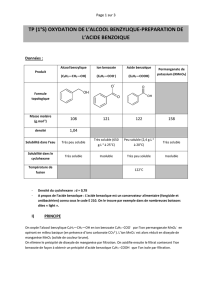
Données physico-chimique concernant les espèces chimiques utilisées dans la synthèse.
pKA1 (C6H5COOH/C6H5COO-) = 4,20
pKA2 (H3O+/H2O) = 0,0
Solubilité de l'acide benzoïque dans l'eau:
1,5 g.L-1 à 10°C ; 2,4 g.L-1 à 25°C ; 68 g.L-1 à 95°C
NOM
FORMULE
M(g.mol-1)
fusion
(°c)
Solubilité
dans l’eau
Densité
Solubilité
dans le
cyclohexane
Alcool
benzylique
C6H5CH2OH
108
-15,3
Soluble
1,05
Grande
Benzoate de
sodium
C6H5COONa
144
>300
Très
soluble
1
Insoluble
Acide
benzoïque
C6H5COOH
122
122
Peu soluble
Très faible
Permanganate
de potassium
KMnO4
158
50
soluble
Insoluble
Cyclohexane
0,78
1
/
3
100%