Corrigés de chimie-fin TD-avril2010-v2

Corrigés de chimie
Voici les corrigés des derniers exercices de chimie non corrigé (TD dérivés d’acide et TD
diagrammes E-pH).
TD chimie organique dérivés d’acide
Exercice n°4 : synthèse de l’aspartame. L’énoncé du TD était incorrect (il manquait la
formule de l’acide aspartique et il y avait une erreur dans la formule du I.1)
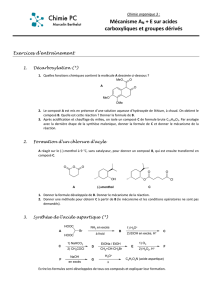
L’aspartame, formé à partir de deux acides aminés, la phénylalanine et l’acide aspartique, a pour
formule :
HOOC COOH
NH
2
NH
2
O
OH
H
2
NNO
H
HOOC-CH
2
O
H O
H CH
2
C
6
H
5
Acide aspartique Phénylalanine Aspartame
La liaison formée est une liaison peptidique, ou liaison amide, entre la fonction amine d’un des
acides aminés (ici la phénylalanine) et la fonction acide carboxylique de l’autre acide aminé (ici,
l’acide aspartique).
Le plus souvent, en synthèse peptidique, la fonction amine d’un des acides (ici, l’acide aspartique)
est bloquée par un groupement butoxycarbonyle (noté Boc), tandis que la fonction acide
carboxylique de l’autre acide aminé (ici, la phénylalanine) est estérifiée. La liaison peptidique est
ensuite réalisée par couplage des deux fonctions restées libres.
1) Blocage de la fonction amine de l’acide aspartique
(CH
3
)
3
COH + CO
2
+
H
2
N CH COOH
R
1
+(H
3
C)
3
CO C O
O
C OC(CH
3
)
3
O
(H
3
C)
3
CO C NH
O
CH
R
1
COOH
1.1)
Préciser le comportement nucléophile ou électrophile de chacun des réactifs.
1.2)
Par analogie avec les réactions des dérivés d’acide, proposer un mécanisme pour cette réaction
en milieu basique. Le composé obtenu sera noté : Boc–NH–CH(R
1
)–COOH
2) Activation de la fonction acide carboxylique de l’acide aspartique par le dicyclohexyl-
carbodiimide (DCC) et couplage
Le DCC a pour formule :
Ce composé est noté : R’N=C=NR’
N C N

La fonction acide carboxylique est activée ainsi :
Boc–NH–CH(R
1
)–COOH + R’N=C=NR’
NH CHBoc
R
1
C
O
O C
NR'
NHR'
Le composé formé est une O-acyrulée.
2.a) Proposer un mécanisme pour cette réaction
2.b) Pourquoi le carbonyle de l’O-acyrulée formé est-il plus réactif vis-à-vis d’une substitution
nucléophile que le carbonyle d’une fonction acide carboxylique ?
2.c) Citer deux autres fonctions derives d’acide carboxylique, plus réactives qu’un acide
carboxylique dans une reaction d’acylation.
3) Couplage avec la phenylalanine estérifiée puis déprotection
Le composé précedent réagit ensuite avec la phenylalanine estérifiée H
2
N–CH(R
2
)–COOCH
3
.
On obtient le composé suivant :
NH CHBoc
R
1
C
O
NH CH COOCH
3
R
2
3.a) Proposer un mécanisme pour cette reaction.
3.b) La liberation de la fonction amine pour restituer le peptide (l’aspartame) s’effectue par
hydrolyse acide dans des conditions douces. Dans ces conditions, il a été montré que le retour à la
fonction amine passe par un carbocation, le 1,1-diméthyléthyle, et que l’on observe la formation de
2-méthylpropène et de dioxide de carbone.
Proposer un mécanisme pour cette reaction.

Synthèse de l’aspartame : corrigé


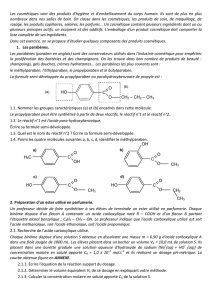
Exercice n°5 : synthèse organique (oral 08)
Un diacide A est mis en solution dans l’éthanol en présence d’acide sulfurique. On isole un
composé B dont le spectre RMN est le suivant :
- à 1,2 ppm : triplet d’intégration 5,4 cm
- à 1,4 ppm : doublet d’intégration 3,6 cm
- à 3,4 ppm : quadruplet d’intégration 3,6 cm
- à 4,2 ppm : quadruplet d’intégration 0,9 cm
1) Nommer la réaction qui s’est produite et donner son mécanisme.
2) Identifier le composé B et en déduire la structure de A.
3) Le composé B est mis en solution avec une base forte. On ajoute ensuite du bromure de benzyle
Ph-CH
2
-Br à cette solution. Après traitement, on isole le composé C. Expliquer sa formation.
4) Le composé C est ensuite chauffé en présence de soude puis le composé obtenu est chauffé en
milieu acide. On obtient le composé D. Identifier D et justifier rapidement sa formation (sans
détailler les mécanismes).
5) On fait ensuite réagir le composé D avec le chlorure de thionyle SOCl
2
. On ajoute du trichlorure
d’aluminium. Après traitements, le composé E (C
6
H
10
O) est isolé. Donner le mécanisme de cette
réaction ainsi que la structure de E.
Réponses :
1) Estérification en catalyse acide. Mécanisme classique. On a un diester.
2) On a 2 groupements CH
3
-CH
2
-O-
Le CH
3
donne le triplet à 1,2 ppm et le CH
2
le quadruplet à 3,4 ppm.
6 H donnent 5,4 cm et 4 H : 3,6 cm. Un H correspond donc à 0,9 cm.
Il reste donc un CH
3
(intégration 2,7 cm) et un H, couplés.
B est donc le composé suivant :
O O
O O
3) Le H en alpha des 2 C=O est acide. On déprotone donc B puis on
obtient C par S
N
:
O O
O O
Ph
4) C subit une saponification puis une décarboxylation. Donc D :
HO Ph
O
5) Avec SOCl
2
D donne : Cl Ph
O
puis par S
E
Ar intra : E
O
 6
6
1
/
6
100%