Physique – Chimie DS n°5 – corrigé

Physique – Chimie DS n°5 – corrigé Classe : 1S
la
Exercice 1 : Réacteur nucléaire ITER
1. équation de cette fusion nucléaire. :
H
1
2
+
H
1
3
→
He
2
4
+
n
0
1
2. La température du milieu doit être de l'ordre de 100 millions de degrés pour vaincre la force de
répulsion qui s'exerce entre le noyau de deutérium et celui de tritium qui sont tous deux chargés
positivement.
3. Énergie libérée :
a) On utilise la relation : Elibérée = |Δm| x c². Calculons dans un premier temps le défaut de masse :
Δm = mproduits – mréactifs = 4,00151 + 1,00866 – (2,01355 + 3,01550) = -0,01888 u = - 0,01888 x
1,66054.10-27 = - 3,135.10-29 kg
Elibérée = |Δm| x c² = 3,135.10-29 x (2,99792458.108)² = 2,818.10-12 J = 2,818.10-12 / 1,60218.10-19
= 17,59.106 eV = 17,59 MeV = 17,6 MeV. L'énergie libérée est bien égale à 17,6 MeV.
b) Ici, 2 + 3 = 5 nucléons participent à la réaction de fusion. Donc l'énergie libérée par nucléon
participant à la réaction est égale à E/n = 17,6 / 5 = 3,52 MeV.
4. Désintégration du tritium :
a) équation de désintégration :
H
1
3
→
He
2
3
+
e
−1
0
+
̄
ν
0
0
. La particule β- émise est un électron.
b) Il existe aussi la désintégration β+ dont la particule émise est le positon de symbole
e
1
0
. Le
dernier type de désintégration est la désintégration α dont la particule est un noyau d'hélium
de symbole
He
2
4
.
c) « de demi-vie 12,3 ans » signifie que tous les 12,3 ans, l'activité de l'échantillon est divisée
par deux.
5. Fission :
a) équation de réaction :
n
0
1
+
U
92
235
→
Xe
54
139
+
Sr
38
94
+ 3
n
0
1
. Les deux lois de conservation
utilisées sont la conservation du nombre de nucléons (235 + 1 = 139 + 94 + 3x1) et la
conservation du nombre de charges (0 + 92 = 54 + 38 + 0).
b) Ici, 235 + 1 = 236 nucléons participent à la réaction de fission. Donc l'énergie libérée par
nucléon participant à la réaction est égale à E/n = 180,0/ 236 = 0,7627 MeV.
6. Les avantages que présenterait l'utilisation de la fusion nucléaire par rapport à la fission pour la
production d’électricité dans les centrales nucléaires sont :
•une quantité d'énergie libérée par nucléon plus importante (multipliée par 4)
•une gestion des déchets nucléaires facilitée car les déchets sont de plus faible activité
et ont des durées de vie bien plus courtes.
Exercice 2 : Préparation d'une solution par dissolution
On souhaite préparer une solution aqueuse à partir du solide ionique chlorure de fer III : FeCℓ3.
1. les trois étapes de la dissolution d'un solide ionique dans l'eau sont :
◦la dissociation du solide ionique,
◦la solvatation appelée hydratation dans le cas de l'eau,
◦la dispersion des ions solvatés ou hydratés dans le cas de l'eau dans le solvant.
2. « les ions sont hydratés » signifie qu'ils sont entourés par des
molécules d'eau. La molécule d'eau étant polaire, elle présente sa
partie comportant une charge partielle négative en direction des cations
(atome d'oxygène) et inversement pour les anions.
3. équation de dissolution : FeCℓ3(s) → Fe3+(aq) + 3 Cℓ-(aq)
4. Équation de la réaction chimique FeCℓ3(s) → Fe3+(aq) + 3 Cℓ-(aq)
État du système Avancement (mol) Quantité de matière (en mol)
Initial x = 0 n(s) 0 0
Final xmax n(s) – xmax xmax 3 x xmax
5. c(s) = n(s) / V ; [Cℓ-(aq)] = (3 x xmax) / V = 3 x (xmax / V). Or, comme la solution n'est pas saturée, il
ne reste pas de solide à l'état final, donc n(s) – xmax = 0 donc n(s) = xmax. D'où [Cℓ-(aq)] = 3 x (n(s) /
V) = 3 x c(s).

6. [Cℓ-(aq)] =
3xc(s)=3×n
V=
3×m
M
V=3×m
M×V
donc m = ([Cℓ-(aq)] x M x Vsol) / 3 = 1,50.10-2 x 270 x
200.10-3 / 3 = 0,270 g. Il faut peser 0,270 g de chlorure de fer III pour réaliser la solution.
* m = ([Cℓ-(aq)] x M x Vsol) / 3 = 1,70.10-2 x 270 x 500.10-3 / 3 = 0,765 g. Il faut peser 0,765 g de
chlorure de fer III pour réaliser la solution.
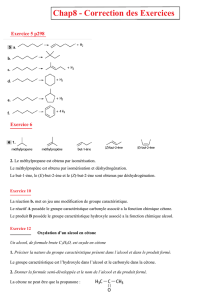
Exercice 3 : Propriétés physiques et chimiques de molécules isomères
1. Dans l'éthanol comme dans le méthoxyméthane, des liaisons de Van der Waals de même
intensité existent entre les molécules car elles sont isomères. L'éthanol peut également établir
des liaisons hydrogène intermoléculaires, grâce à la présence d'un groupement hydroxyle (-
OH). La température d'ébullition de l'éthanol sera donc plus élevée car il y a plus de liaisons
intermoléculaires à rompre que dans le méthoxyméthane.
2. Les deux molécules sont polaires car leur centre des
charges positives et leur centre des charges négatives
ne sont pas confondus. Elles sont donc solubles un
solvant polaire, comme le bromométhane.
3. Le méthoxyméthane établit des liaisons de VdW avec les molécules d'eau. Tandis que l'éthanol
établit des VdW et des liaisons hydrogène avec les molécules d'eau (groupe -OH). Plus il y a
de liaisons entre molécules, meilleure est la solubilité. Ce qui explique la meilleure solubilité de
l'éthanol dans l'eau.
Exercice 4 : Le temps est à l'orage
1. Le champ électrostatique est orienté du pôle positif vers le pôle négatif. Comme il est dirigé
vers le sol, par beau temps, la charge électrique à la surface du sol est négative.
2. La surface du sol se charge positivement sous un cumulo-nimbus car ces nuages sont chargés
négativement à leur base. Ils attirent donc les charges positives et repoussent les charges
négatives du sol. Le sol se charge donc positivement à sa surface.
3. Le sol est horizontal, plan et chargé positivement. Le bas du nuage est horizontal, plan et
chargé négativement. On peut donc modéliser le système sol-partie inférieure du nuage, par un
condensateur plan.
4. Le champ électrostatique, entre les armatures d'un condensateur plan, est uniforme et dirigé de
l'armature chargée positivement vers l'armature chargé négativement.
5. Schéma ci-contre :
Question bonus : Exercice 1
Deutérium : q1 = e (1 proton dans le noyau) ; tritium : q2 = e (1 proton dans le noyau)
FE=k×∣q1×q2∣
d2=k×e2
d2=9,0.109×(1,6.10−19)2
(1,0 x10−15)2=2,3.102N
La force électrostatique de répulsion entre le noyau de deutérium et celui de tritium lorsqu'ils sont à une
distance de 10-15 m est de 2,3.102 N.
*
FE=k×∣q1×q2∣
d2=k×e2
d2=9,0.109×(1,6.10−19)2
(1,0 x10−14)2=2,3N
La force électrostatique de répulsion entre le noyau de deutérium et celui de tritium lorsqu'ils sont à une
distance de 10-14 m est de 2,3 N.
G+
G-
G-
G+
2
1
/
2
100%