Oses - Eduscol

C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 1/11
GLUCIDES
Filiation des aldoses

C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 2/11
Filiation des cétoses
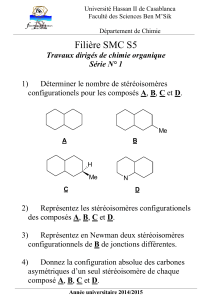
Exercice 1
1. Citer un aldotétrose et un cétotriose. Commenter leur formule développée. Quels sont les
critères de classification des oses ?
2. Comment passe-t-on d’un aldose de la série D à n carbone aux deux aldoses de la série D à
(n+1) atomes de carbone qui en dérivent ?
3. Pourquoi ne précise-t-on pas D ou L dihydroxyacétone ?
4. Les oses sont-ils tous réducteurs (justifier la réponse).
5. Parmi les hexoses citer deux épimères en C2 et deux diastéréoisomères. Un aldohexose et
un céthexose sont-ils isomères ? Si oui, de quel type d’isomérie s’agit-il ?

C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 3/11
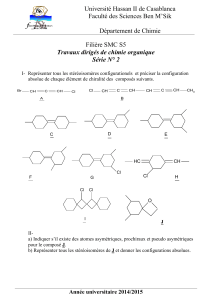
Exercice 2
1. Quelle est la configuration absolue (R ou S) des carbones
asymétriques de l'amino-sucre I représenté ci-contre en projection de
Fischer ?
2. Complétez la représentation de Cram de ce composé.
3. Combien existe-t-il de diastéréoisomères du stéréoisomère I représenté ?
4. Quelle relation de stéréoisomérie existe-t-il entre ce stéréoisomère I et le composé de
configuration (2R, 3S, 4R) ?
Exercice 3
Le (-)-ribose J, dessiné en représentation de Cram ci-
dessous, est un constituant important des acides
ribonucléiques (ARN) et possède un pouvoir rotatoire
spécifique [α]D25= - 20,0.
1. Représentez ce sucre en projection de Fischer.
2. En justifiant votre réponse, précisez à quelle série (D
ou L) appartient ce sucre.
3. Représentez en projection de Fischer le ribose de la
série opposée (énantiomère de J).
4. Le (+)-ribose est un produit peu abondant dans la nature et doit être synthétisé. A l’issue de
l’une de ces synthèses, l’analyse d’un échantillon a montré que le produit obtenu était un
mélange de 80% de (+)-ribose et de 20% de (-)-ribose.
4.1 Quelle est la pureté optique de l’échantillon ? On supposera que la pureté optique est égale
à l’excès énantiomérique.
4.2 En déduire le pouvoir rotatoire spécifique du ribose obtenu. Justifiez son signe.
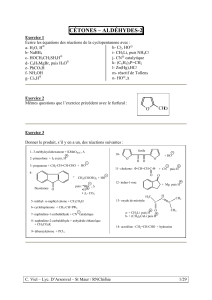
Exercice 4
1- Par quelle réaction peut-on passer du mannose au mannitol ? Proposer un réactif.
CHO
HO
OH
CH2OH
HO
OH
CH2OH
CH2OH
HO
HO
OH
OH
mannose mannitol
Indiquer la nomenclature R ou S des carbones asymétriques 2 et 5.
H2N
CHO
HO
CH2OH
HO
CHO
1
2
3
45
CHOHOH2C
HOH
OH
HOH
H
composé J

C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 4/11
2- Le mannitol M réagit sur deux molécules de propanone en milieu acide sans mettre en
jeu les fonctions alcools des carbones 3 et 4.
Le composé N formé peut être coupé, par oxydation ménagée par l’acide périodique
en un composé O.
Ecrire les formules de N et de O en adoptant la projection de Fisher.
L’hydrolyse acide de O conduit uniquement à de la propanone et du glycéraldéhyde.
Celui-ci est-il racémique ou optiquement actif ? Dans ce derner cas quelle est sa
configuration absolue ?
Exercice 5
Le D-glucose peut être transformé en D-fructose et en D-mannose en milieu basique, via la
formation renversable d’un ion énolate. Dessiner cet ion et expliquer ces transformations.
CHO
HO
OH
CH2OH
HO
OH
D-mannose
CH2OH
CH2OH
HO
OH
OH
O
D-fructose
CHO
OH
OH
CH2OH
OH
HO
D-glucose
Exercice 6
La majeure partie de la vitamine C commercialisée est obtenue par synthèse à partir du L-
sorbose. La première étape de cette synthèse consiste à faire réagir la propanone en large
excès et en milieu acide sur le L-sorbose (I).
1- Donner la configuration absolue des atomes de carbone asymétriques 3, 4 et 5 en
justifiant l’ordre des priorités.
2- Représenter en projection de Fischer le L-sorbose(I). Justifier la notation L-sorbose.
3- Il existe un équilibre entre la forme ouverte (I) et la forme cyclique du L-sorbose qui
s’obtient par réaction d’hémiacétalisation interne entre la fonction alcool portée par
l’atome de carbone 5 et la fonction cétone (carbone 2). Ecrire le mécanisme
d’hémiacétalisation interne catalysée par les ions H⊕ à partir de la représentation de
Fischer.
4- On considère la forme cyclique (II) du L-sorbose
suivante :
a- Donner la configuration absolue de
l’atome de carbone 2 dans la
configuration en justifiant l’ordre de
priorité des substituants.
b- On bloque les fonctions alcools portées
par les atomes de carbone 2 et 3 d’une
part, 4 et 6 d’autre part, en fonctions acétals, par la propanone en milieu acide.
Représenter le produit final en prenant pour modèle la représentation cyclique
du L-sorbose.
O
CH2OH
OH
OH
OH
HOH2C
L-sorbose(II)
2
3
4
5
6

C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 5/11
c- On oxyde la fonction alcool restante par le permanganate de potassium. Quel
composé obtient-on ? Quel était l’intérêt de l’acétalisation décrite en 4-b- ?
d- On réalise ensuite une hydrolyse acide du composé obtenu. On obtient A.
Représenter A sous sa forme cyclique.
5- Le produit A précédent, sous sa
forme ouverte, est l’acide 2-
oxo-L-gulonique. Sa projection
de Fischer est la suivante :
6- Cette molécule peut donner lieu
à une réaction d’estérification
interne (lactonisation) par
réaction entre la fonction alcool
portée par l’atome de carbone 4
et la fonction acide
carboxylique.
a- Écrire le mécanisme réactionnel d’estérification interne en milieu acide à partir
de la représentation de Fischer.
b- Montrer que le composé obtenu par un équilibre dont on précisera la nature,
donne la vitamine C (ci-dessus). Expliquer pourquoi l’équilibre précédent est
fortement déplacé dans le sens de la formation de la vitamine C.
Exercice 7
On s’intéresse à la transformation du fructose-1,6-diphosphate (FDP) en
dihydroxyacétonephosphate (DHAP) et glycéraldéhyde-3-phosphate (G3P).
CH2OPO3
HHO
HOH
HOH
2
O
CH2OPO3
2
O
CH2OPO3
2
OH
CH2OPO3
2
HO
HO
H
H
H
FDP furanose
FDP forme
ouverte
23
4
5
6
1
La stéréochimie du carbone 2
n'est pas précisée
équilibre (1)
1- Quelle est la nature de la réaction (1) qui donne l’équilibre entre la forme cyclique
furanose et la forme ouverte du FDP ?
Donner la numérotation des carbones de la forme ouverte en correspondance avec la
forme cyclique.
Représenter les deux stéréoisomères du FDP cyclique. Quelle est leur relation de
stéréoisomérie ? Quel est celui qui est le plus stable ?
Quelle série D ou L appartient le FDP ? Justifier ;
2- La réaction (2) est la transformation étudiée :
COOH
O
HO
OH
HO
CH2OH
1
2
3
4
5
6
acide 2-oxo-L-gulonique
OO
OHHO
HC
CH2
H
OH
HO
Vitamine C
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%