transferts thermiques - Lycée Jacques Monod, CLAMART

Physique-Chimie 1 S
Comprendre
Lycée Jacques Monod
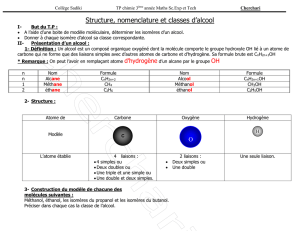
Cohésion des solides : un solide peut être ionique (NaCl), atomique
(Cu) ou moléculaire (H
2
O)selon la nature des liaisons qui s'établissent
entre ses constituants.
Liaisons ioniques.
1) Comment expliquer brièvement la cohésion d'un solide ionique ?
Liaisons Van der Waals.
La cohésion des solides moléculaires est due à des interactions, appelées forces de Van der Waals.
"L'interaction de van der Waals est une interaction électrique de faible intenisté entre des atomes,
des molécules. Elle est associée à des forces attractives généralement en 1/r
7
, de très courte portée.
Les forces de Van der Waals sont d'autant plus grandes que les électrons sont nombreux et la
molécule étendue"
2) Les forces de van der Waals sont dues à quelle interaction : forte, faible, eléctromagnétique,
gravitationnelle ?
3) Quelle est la portée de ces forces exprimée en mètre ?
4) Qu'est-ce qu'une molécule polaire ?
5) Dans quel cas un atome peut être qualifié de polaire ?
TRANSFERTS THERMIQUES
Quand deux atomes sont distants de 5 nanomètres l'un
de l'autre, une interaction faible entre eux, provoque
ainsi la
polari
té
et une légère attraction.
cristal de chlorure de sodium
La polarité est une caractéristique décrivant la répartition des charges positives et négatives . La
polarité d'une molécule est due à la différence d'électronégativité des atomes qui la composent.
L'électronégativité d'un atome est la capacité qu'a cet atome d'attirer à lui les électrons quand il est
engagé dans une liaison chimique avec un autre atome. Plus les charges sont réparties de façon
asymétrique plus la molécule sera polaire. Si les charges sont réparties de façon totalement symétrique
la molécule sera apolaire.

Physique-Chimie 1 S
Comprendre
Lycée Jacques Monod
Liaisons hydrogène.
6) Expliquer le terme "liaisons intermoléculaires". Les liaisons covalentes peuvent-elle être
qualifiées ainsi ?
7) Quelle interaction permet d'expliquer la présence des liaisons hydrogène ?
Aspect énergétique d'un changement d'état
Energie molaire de fusion de la glace.
L’énergie molaire de fusion de la glace est l’énergie qu’il faut fournir pour faire fondre une mole de
glace initialement à la température de 0°C. Comment déterminer cette grandeur ?
Protocole :
• Introduire 100 mL d’eau distillée dans le calorimètre et le fermer.
• Mesurer la température
θ
i
de l’eau dans le calorimètre.
• Peser le calorimètre contenant l’eau.
• Prendre deux glaçons fondants à température
θ
= 0°C, les essuyer avec du papier absorbant
et les introduire rapidement dans le calorimètre.
• Noter la température
θ
f
de l’eau juste à la fin de la fusion des glaçons.
• Peser le calorimètre à la fin de la fusion.
Exploitation :
8) D’où provient l’énergie qui a permis de faire fondre la glace ?
9) Calculer la masse m d’eau provenant de la glace fondue au cours de l’expérience.
10) Calculer la quantité de matière n correspondante.
11) Pourquoi relève-t-on la température juste lorsque le dernier cristal de glace a fondu
12) Pour élever la température d’une masse de 1,0 g d’eau liquide de 1,0°C, il faut fournir une
énergie de 4,18 J.
Pour élever la température de 2,0 g d’eau liquide de 3,0°C, il faut une énergie de 2,0 × 3,0 × 4,18 J.
Calculer l’énergie reçue E
reçue
par la glace.
13) L’énergie reçue par mole de glace passant de l’état solide à l’état liquide à la température de
0°C est appelée énergie molaire de fusion et noté E
m,fus
. Calculer E
m,fus,exp
pour cette expérience.
14) Critique de la méthode : la valeur théorique de l’énergie reçue par mole de glace est
E
m,fus, théo
= 6,0 kJ.mol
-1
. A quoi peut être dû l’écart avec la valeur expérimentale ?
Donnée : masse volumique de l’eau : ρ = 1,0 g.mL
-1
Les liaisons hydrogène sont des liaisons intermoléculaires qui ne
s'établissent qu'entre certaines molécules et qui implique
toujours un atome d'hydrogène.
Elles sont vingt fois moins solides que les liaisons covalentes, et
elles sont dix fois plus solides que les liaisons de Van der Waals.

Physique-Chimie 1 S
Comprendre
Lycée Jacques Monod
Chaleur latente de vaporisation de l'eau
On souhaite déterminer l'énergie nécessaire pour vaporiser une masse d'eau liquide à 100 °C.
Protocole :
• Dans un ballon à fond rond, verser environ 100 mL d'eau distillée, le poser sur un valet. Noter la
masse m
1
de l'ensemble (ballon + eau + valet). Placer le ballon dans un chauffe-ballon et relever
la puissance du chauffe-ballon.
• Lancer l'Atelier Scientifique, puis sélectionner l'icône "généraliste pour les sciences physiques et
chimiques" (en haut à gauche) et valider avec OK (en bas à droite).
Sélectionner les voies : par un "cliquer -glisser " placer l'icône thermocouple en ordonnée, et
l'icône chronomètre en abscisse.
Paramétrer les voies :
- sur l'axe des ordonnées : onglet calibre : sélectionner 10/110 °C
- sur l'axe des abscisses : onglet fonction du temps : durée de l'acquisition 20 min
• Mettre le chauffe-ballon en fonctionnement et lancer l'acquisition, laisser l'ébullition se dérouler
10 minutes.
• Au bout de cette durée, attendre que le ballon refroidisse (en abaissant le support élévateur),
placer le ballon sur un valet et effectuer une pesée de l'ensemble (ballon + eau + valet). Noter la
masse m
2
obtenue.
• Déterminer la durée de l'ébullition à l'aide du tableau de valeurs (pendant l'ébullition la
température reste constante).
Exploitation :
16) L'énergie électrique W
él
est égale au produit de la puissance par la durée. Calculer l'énergie
électrique consommée lors de l'ébullition.
17) On considère que toute l'énergie fournie à l'eau sert à effectuer le changement d'état.
On obtient alors : W
él
= mL
V
W
él
: énergie électrique fournie au système en joules (J)
m : masse d'eau vaporisée en kg
L
V
: chaleur latente de changement d'état (en J.kg
−1
)
Déterminer lachaleur latente L
V, exp
.
18) Comparer la valeur obtenue avec la valeur théorique L
V,théo
= 2 256 kJ.kg
−1
.
19) Pourquoi obtient-on une valeur différente ? Argumenter en citant au minimum deux causes
d'erreurs expérimentales.
1
/
3
100%