Thème 6 Les composés chimiques (pp. 136

1
Thème 6
Les composés chimiques (pp. 136-144)
L’objectif:
□ Je vais faire la distinction entre les composés ioniques et moléculaires et
décrire les propriétés de certains exemples courants des uns et des autres
□ Je vais lire et interpréter les formules chimiques de composes a deux
éléments et citer leur appellation courante
□ Je vais monter ou dessiner des modèles moléculaires ou ioniques simples
Du Texte (p.138 et p. 140)
Tableau 2.5 – Des composes moléculaires courants
Dessine le tableau –
Nom
Formule
Description
Monoxyde de
carbone
CO (g)
Gaz toxique
Tétrachlorure de
carbone
CCL 4(l)
Solvant organique
Dioxyde de
silicone
SiO2(s)
Composant majeur du sable et du verre
Dioxyde de
soufre
SO2(g)
Résultat du soufre brulé, un composant des
pluies acides
Définition de la conductibilité - est la propriété qu’a une substance
de conduire un courant électrique.

2
Comment peut-on utiliser la conductibilité pour déterminer si un composé
est ionique ou moléculaire? – un test simple de conductibilité pour savoir
si ca conduit de l’électricité.
Du Powerpoint
Les Composés Chimiques
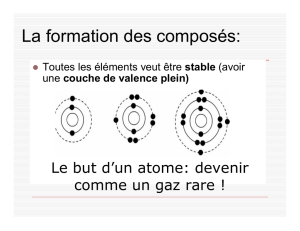
Nous savons que les atomes d’éléments variés se
__joignent_________ ensemble pour former des molécules et des
composés. Mais, comment? Les éléments sont lies ensemble par des
__liens________ __chimiques_______. Ces liens sont formes quand les
éléments gagnent, __perdent_____________ ou partagent des
électrons. Comme nous avons vu avec les diagrammes de « Bohr », les
électrons ___voyagent_____________ autour du __noyau__________
dans des niveaux d’énergie. Chaque atome essaye de
___devenir____________ stable et leur niveau d’énergie externe est
___plein________, comme les gaz nobles. Les atomes vont gagner,
perdre ou ___partager______________ les électrons pour devenir
stable et donc deviennent les __composés____________.
Si les atomes perdent ou gagnent les électrons à d’autres atomes, ceci
est appelé une __Liaison _____ ___Ionique______________ et forme
un ___Composé___________ __Ionique_______________. Les
composés ioniques peuvent seulement former entre un
_metal____________ et un non-métal.

3
Si les atomes __partagent_______________ les électrons avec
d’autres atomes, ceci est appelé une _Liaison_______________
__Moleculaire______________ ou liaison covalente et forme un
__Composé_____________ __Moleculaire_____________. Les
composés moléculaires peuvent seulement former entre un __non-
metal______________ et un non-métal.
Les Composés Ioniques
Le sodium a un numéro atomique de 11. Ceci veut dire que le niveau
d’énergie externe a seulement un électron. L’atome veut devenir
__stable_________. Donc, s’il pouvait __abandonner_______________ un
électron, l’atome va être stable. Ceci est correct. Mais le
___charge________ total de l’atome n’est plus __neutre_______ parce
que maintenant il y a plus de _protons______________ qu’électrons. Ceci
veut dire que l’atome est maintenant « __ionique_____________ » et
contient une charge. Ce que la nouvelle charge contient __dépend_______
du nombre d’électrons gagnés ou perdus.
Dessine le sodium et l’information dans la boite -
Abandonne un électron = 11 protons, 10 électrons, Charge est maintenant +1

4
Tous les éléments qui sont des métaux on une charge ionique qui est
___positive____________ parce qu’ils abandonnent les électrons. Tous les
___non-metaux______________ qui ne sont pas stables (tous les gaz
_nobles___________) ont une charge ionique ____negative_________
parce qu’ils gagnent des électrons pour devenir ___stable___________.
Ceci est vrai pour tous sauf les __metalloides__________________. Les
charges ioniques des métalloïdes peuvent __varier_____________.
Dessine le Fluor et l’information dans la boite -
Gagne un électron = 11 protons, 12 électrons, Charge est maintenant -1
Les Composés Moléculaires
Les composés moléculaires sont créés en __partageant______ des
électrons entre deux non-métaux, pour que les deux
_puissent____________ devenir stable.
Voyez comment les deux niveaux d’énergies externes entrent dans
l’orbite de chacun des non-métaux. Ceci permet chaque atome de partager
deux électrons pour devenir stable.
Dessine les molécules d’oxygène :

5
Les Propriétés des Composés
Les Composés Ioniques
Les Composés Moléculaires
Se forme des éléments
métalliques + non métalliques
D’habitude se forme
seulement des éléments non
métalliques
Forment des ions en solution
Ne forment pas des ions en
solution
Conduit l’électricité
Ne conduit généralement pas
l’électricité
Solide à la température
ambiante
Solide, liquide ou gaz a la
température ambiante
« Les liaisons moléculaires sont ___generalement________________
pas aussi __fortes_________ que les liaisons ioniques »
Les formules chimiques
Les scientifiques ont développé une méthode plus rapide de
__representer____________ les éléments et les composes. Les
__symboles__________ pour les éléments sont montrés dans le Tableau
Périodique. Les combinaisons de ces symboles sont utilisées pour
représenter les composés.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%