CH 2

Physique chimie 4 Analyse spectrale
I. Spectroscopie U.V. - Visible :
1. Principe :
La spectroscopie U.V. (200 – 400 nm) ou Visible (400 – 800 nm) est l’étude quantitative des interactions
entre la matière et la lumière.
Lorsque la lumière traverse une substance, elle est en partie transmise et en partie absorbée. On définit alors
la transmittance T et l’absorbance A de la substance comme des grandeurs physiques sans unités, liées à la
proportion de lumière transmise et absorbée.
L’appareil permettant la mesure de l’absorbance A est le spectrophotomètre.
Exemple de la solution de permanganate de potassium.
Une substance colorée absorbe dans le domaine visible du
spectre des radiations électromagnétiques.
Sa couleur résulte de la synthèse additive des couleurs
complémentaires des radiations absorbées.
Etoile des couleurs complémentaires
Plus une molécule possède de doubles liaisons conjuguées
>C=C<, plus la longueur d’onde des radiations absorbées
augmente.
0
0.5
1
1.5
2
350 400 450 500 550 600 650 700 750
A (-)
λ(nm)
A = f(λ)
λmax = 545 nm

2. La loi de Beer-Lambert.
Les lois régissant l’absorption de la lumière par une substance colorée ont été formulées en 1730 par J.H.
Lambert et généralisées aux solutions par A. Beer en 1852.
L’absorbance ou densité optique A d’une solution peu concentrée en substance absorbante est, à une
température donnée, proportionnelle à l’épaisseur l de solution traversée par la lumière et à la concentration
c de la substance :
A = ε(λ) × l × c
A : absorbance de la solution (sans unité)
l : épaisseur de solution traversée par la lumière (cm)
c : concentration molaire de la substance dans la solution (mol.L-1)
ε(λ) : coefficient d’extinction molaire (L.mol-1.cm-1) ou coefficient d’absorption molaire ou
absorbance linéique molaire, qui dépend de la nature de la substance, de la longueur d’onde de la
lumière, de la nature du solvant et de la température.
Une espèce chimique est caractérisée par la longueur d’onde de son maximum d’absorption λmax et par son
coefficient d’absorption molaire correspondant ε(λ).
II. Nomenclature de quelques familles de composés organiques :
1. Groupes caractéristiques et fonctions chimiques :
La plupart des molécules organiques sont constituées d’un squelette carboné (atomes de carbones) appelé
chaîne carbonée et d’un ou plusieurs groupes caractéristiques.
Les molécules possédant les mêmes groupes caractéristiques présentent des propriétés chimiques voisines.
Ces propriétés permettent de définir une fonction chimique. Les molécules sont alors regroupées dans des
familles caractérisées par une fonction chimique.
2. Formule topologique d’une molécule :
Une molécule peut être écrite sous forme développée, semi-développée ou topologique.
Dans la formule topologique,
- Une liaison simple carbone – carbone est représentée par un trait,
- Une double liaison est représentée par deux traits,
- Seuls les atomes autres que ceux de carbone et d’hydrogène sont écrits,
- Les atomes d’hydrogène sont écrits seulement s’ils sont liés à d’autres atomes que de carbone.
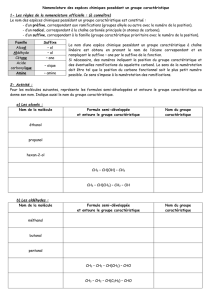
Fonction
Alcool
Aldéhyde
Cétone
Acide carboxylique
Groupe
caractéristique
— O —H
Ou
— OH
Hydroxyle
ou
Carbonyle
ou
Carbonyle
ou
Carboxyle
Fonction
Alcène
Ester
Amine
Amide
Groupe
caractéristique
Alcène
Ester
Amine
Amide
O
C
H
CHO
C
O
C
C
C
CO
C
O
C
OH
COOH
C
C
C
O
C
O
N
O
C
N

Exemples
3. Nomenclature :
a. Nomenclature des alcènes :
Le nom d’un alcène s’obtient en remplaçant le suffixe –ane du nom de l’alcane correspondant à la chaîne
carbonée principale par le suffixe –ène précédé de l’indice de position le plus petit possible de la double
liaison C=C.
Le nom, la position des ramifications ainsi que l’isomérie Z / E lorsqu’elle existe, sont également précisés.
Exemples
b. Nomenclature des esters :
Le nom d’un ester comporte deux termes :
- Le premier qui se termine en – oate, désigne la chaîne dite principale provenant de l’acide
carboxylique. Cette chaîne est numérotée à partir du carbone fonctionnel.
- Le second qui se termine en – yle, est le nom du groupe alkyle provenant de l’alcool.
Cette chaîne est numérotée à partir du carbone fonctionnel.
Exemples
Composé
Formule semi-développée
Formule topologique
Cyclohexane
C6H12
Hexane
C6H14
ou
3-méthylpent-1-ène
ou
ou
Butan-2-one
Nom
but-1-ène
2-méthylprop-1-ène
(Z)-but-2-ène
(E)-hex-3-ène
Formule
topologique
Butanoate de méthyle
O
C3H7
C
CH3
O
2-méthylbutanoate de 1-méthyléthyle
O
CH
C
CH
O
CH3
CH2
CH3
CH3
CH3
CH3
CH2
CH2
CH2
CH2
CH3
CH2
CH2
CH2
CH2
CH2
CH2
CH3
(CH2)4
CH3
CH3
CH2
CH
CH3
CH
CH2
CH3
CH2
CH(CH3)
CH
CH2
CH3
CH2
C
O
CH3
O

c. Nomenclatures des amines :
Le nom d’une amine possédant le groupe amino –NH2 dérive de celui de l’alcane de même chaîne carbonée
en remplaçant le e du suffixe –ane par le suffixe –amine, précédé de l’indice de position le plus petit
possible du groupe amine dans la chaîne carbonée principale.
Lorsque l’atome d’azote est lié à d’autres groupes alkyles, le nom de l’amine est précédé de N-alkyl.
Exemples
d. Nomenclature des amides :
Le nom d’un amide possédant le groupe –C(=O)-NH2 dérive de celui de l’alcane de même chaîne carbonée
en remplaçant le e du suffixe –ane par le suffixe –amide.
Lorsque l’atome d’azote est lié à d’autres groupes alkyles, le nom de l’amide est précédé de N-alkyl.
Exemples
III. Spectroscopie Infrarouge :
1. Principe de la spectroscopie IR :
Que la matière soit solide, liquide ou gazeuse, les
atomes des molécules qui la constituent ne sont jamais
immobiles. Ils vibrent de différentes façons.
Ces vibrations peuvent correspondre à une élongation
longitudinale ou à une déformation angulaire.
Leurs énergies associées sont du domaine des
Infrarouges. Elles diffèrent selon le type de liaison et la
nature de ces atomes.
Un spectre infrarouge renseigne donc sur la nature des liaisons d’une molécule et sur les groupes
caractéristiques qu’elle possède.
Il présente en général la transmittance T (en ordonnée) en fonction du nombre d’onde σ = 1/λ en cm-1 (en
abscisse orientée vers la gauche avec une échelle qui n’est pas toujours linéaire).
Nom
butan-2-amine
2-méthylhexan-3-amine
N-éthyl-4-méthylpentan-1-amine
Formule
topologique
Nom
butamide
2-méthylpentamide
N-propyl-3-éthylhexamide
Formule
topologique
O
O
NH2
NH2
NH
O
NH2
NH2
NH

Les liaisons les plus fortes sont situées à gauche du spectre vers les grandes valeurs du nombre d’onde.
Liaison
Nombre d’ondes σ (cm-1)
Importance de l’absorption
(intensité)
O—Hlibre
3580 – 3650
Forte ; bande fine
O—Hlié
3200 – 3400
Forte ; bande large
N—H
3100 – 3500
Moyenne
Ctri—H
3000 – 3100
Moyenne
Ctri—Har
3030 – 3080
Moyenne
Ctét—H
2800 – 3000
Forte
Ctri—Hald
2750 – 2900
Moyenne
O—Hac.car
2500 – 3200
Forte ; bande large
C=Oester
1700 – 1740
Forte
C=Oald.cét
1650 – 1730
Forte
C=Oac.car
1680 – 1710
Forte
C=C
1625 – 1685
Moyenne
C=Car
1450 – 1600
Moyenne
Ctét—H
1415 – 1470
Forte
Ctét—O
1050 – 1450
Forte
Ctét—Ctét
1000 – 1250
Forte
O—Hlibre sans liaison hydrogène O—Hlié avec liaison hydrogène
Ctri : carbone trigonal engagé dans une double liaison
ar : désigne un composé avec un cycle aromatique comme le benzène ou ses dérivés
Ctét : carbone tétragonal engagé dans 4 liaisons simples
ald : aldéhyde cét : cétone ac.car : acide carboxylique
Empreinte digitale de la molécule
Bandes caractérisant des types de liaisons particuliers
 6
6
 7
7
 8
8
1
/
8
100%