Merck annonce la présentation des résultats de l`essai clinique de

Communiqué de presse
POUR DIFFUSION IMMÉDIATE
Relations avec les médias : Relations avec les investisseurs :
Annick Robinson Justin Holko
438 837-2550 908 740-1879
Merck annonce la présentation des résultats de l'essai clinique de phase II visant
à évaluer un traitement expérimental contre l’hépatite C chronique, l’association
grazoprévir/elbasvir, lors
de l'International Liver CongressTM 2015
Les résultats de l’essai C-SALVAGE ont montré que cette association produit des taux élevés de
réponse virologique soutenue chez les patients ayant connu un échec thérapeutique avec un
antiviral à action directe (AAD)
Les résultats de l’essai C-SWIFT permettent de valider le principe d’une diminution de la durée du
traitement avec une combinaison de trois AAD à moins de 12 semaines chez les patients
présentant une infection chronique par les génotypes 1 et 3 du virus de l’hépatite C chronique
(VHC)
Kirkland (Québec), le 25 avril 2015 – Merck (NYSE:MRK), connue sous le nom de MSD à
l'extérieur des États-Unis et du Canada, a annoncé aujourd'hui la présentation des résultats de
deux essais cliniques de phase II évaluant l'innocuité et l'efficacité de son traitement
expérimental administré une fois par jour à base de grazoprévir (100 mg) et d'elbasvir (50 mg)
1
,
chez des patients présentant une infection chronique par le virus de l'hépatite C (VHC). Le
traitement avec l'association grazoprévir/elbasvir et la ribavirine (RBV) [lors de l'essai C-
SALVAGE], a entraîné des taux élevés (plus de 90 %) de réponse virologique soutenue
12 semaines après la fin du traitement (RVS12) chez les patients présentant une infection
chronique par le génotype 1 du VHC, chez les patients atteints d'une cirrhose ainsi que chez les
patients ayant connu un échec thérapeutique avec un traitement d'association au moyen d'AAD.
De plus, les résultats définitifs de l'essai C-SWIFT évaluant le traitement de l'infection chronique
par les génotypes 1 et 3 du VHC avec l'association grazoprévir/elbasvir administrée
conjointement avec le sofosbuvir permettent de valider le principe d’une diminution potentielle
de la durée du traitement de l'infection par le VHC à moins de 12 semaines. Les données de
1
Le grazoprévir est un inhibiteur de la protéase NS3/4A du VHC et l'elbasvir est un inhibiteur du
complexe de réplication NS5A du VHC.

-2-
ces essais ont été présentées à l'International Liver CongressTM 2015 – le 50e congrès annuel
de l'European Association for the Study of the Liver (EASL).
« Nous poursuivons notre programme de phase III sur l'association grazoprévir/elbasvir
auprès de diverses populations de patients présentant une infection chronique par le VHC, y
compris ceux généralement considérés comme faisant partie des plus difficiles à traiter », a
affirmé le Dr Eliav Barr, vice-président, Maladies infectieuses, aux Laboratoires de recherche
Merck. « Les résultats de ces essais de phase II nous ont, en partie, incités à accélérer notre
vaste programme exhaustif de développement clinique qui comprend des essais auprès de
populations de patients dont les besoins médicaux précis ne sont pas comblés. »
Aperçu et résultats de l'essai C-SALVAGE
C-SALVAGE (résumé no O001) est un essai clinique de phase II mené au su et auprès
d’un seul groupe, visant à évaluer l'efficacité et l'innocuité d'un traitement de 12 semaines avec
l'association grazoprévir/elbasvir et la RBV auprès de patients présentant une infection
chronique par le génotype 1 du VHC qui ont connu un échec thérapeutique avec l’interféron
péguylé et la RBV associés à un AAD (bocéprévir, siméprévir ou télaprévir). Sur les 79 patients
qui ont reçu au moins une dose de grazoprévir et d'elbasvir, 43 % étaient atteints d’une
cirrhose.
Après les 12 semaines de traitement avec l'association grazoprévir/elbasvir et la RBV,
96 % (76/79) des patients présentant une infection chronique par le génotype 1 du VHC qui
n’avaient pas répondu à un traitement avec un AAD spécialisé ont obtenu une RVS12. En tout,
94 % (32/34) des patients atteints d'une cirrhose compensée ont obtenu une RVS12. Un échec
virologique a été signalé chez trois patients dans le cadre de l'essai. Ces trois patients
présentaient initialement des variantes associées à une résistance et ont fait une rechute après
la fin du traitement à l’étude.
Les effets indésirables les plus courants incluaient la fatigue (28 %), les céphalées
(19 %), l'asthénie (15 %) et les nausées (12 %). Cinq effets indésirables sévères ont été
rapportés, mais aucun n'a été considéré comme lié au médicament à l'étude. Un patient a
cessé le traitement en raison d'un effet indésirable qui n'était pas considéré comme lié au
médicament à l'étude. Les résultats détaillés de l'essai ont été récemment publiés en ligne à la
section « Articles in Press » de la revue Journal of Hepatology, la revue officielle de l'European
Association for the Study of the Liver (EASL).

-3-
Aperçu et résultats de l'essai C-SWIFT
C-SWIFT (résumé no O006) est un essai clinique de validation de principe de phase II
mené au su, évaluant l'efficacité et l'innocuité de l’association grazoprévir/elbasvir administrée
conjointement avec le sofosbuvir dans le cadre de traitements de plus courte durée. Plus
particulièrement, les patients n'ayant jamais été traités, atteints d'une cirrhose ou non,
présentant une infection chronique par le génotype 1 du VHC, ont reçu le traitement durant 4, 6
ou 8 semaines, et les patients n'ayant jamais été traités, atteints d'une cirrhose ou non,
présentant une infection chronique par le génotype 3 du VHC, ont reçu le traitement durant 8 ou
12 semaines. Les résultats provisoires ont déjà été présentés au 65e congrès de l'American
Association for the Study of Liver Diseases, en novembre 2014.
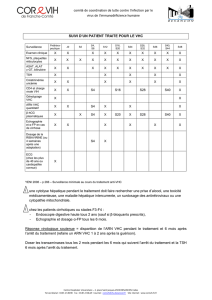
Résultats sur l'efficacité de l'essai C-SWIFT – Analyse modifiée selon le principe de
l'intention de traiter
Génotype
GT1
GT3
Sujets n’ayant
jamais été traités,
non atteints de
cirrhose
Sujets n’ayant
jamais été traités,
atteints de
cirrhose
Sujets n’ayant
jamais été traités,
non atteints de
cirrhose
Sujets n’ayant
jamais été
traités,
atteints de
cirrhose
Durée
(semaines)
**4
6
6
**8
8
12
12
RVS12
33 %
(10/30)
87 %
(26/30)
80 %
(16/20)
94 %
(17/18)
93 %
(*14/15)
100 %
(14/14)
91 %
(10/11)
** L'analyse intention de traiter modifiée a exclu les patients qui ont abandonné l’essai prématurément pour des raisons
autres que l'échec virologique.
Le tableau 1 ci-dessus présente les taux de RVS après 12 semaines pour chaque
groupe de traitement dans la population en intention de traiter modifiée. Parmi les patients
infectés par le génotype 1, une rechute virologique a été signalée chez 20 patients non atteints
de cirrhose traités durant 4 semaines, chez 4 patients non atteints de cirrhose et 4 patients
atteints de cirrhose traités durant 6 semaines, et chez 1 patient atteint de cirrhose traité durant
8 semaines. Parmi les patients infectés par le génotype 3, une rechute virologique a été
signalée chez 1 patient non atteint de cirrhose traité durant 8 semaines et chez 1 patient atteint
de cirrhose traité durant 12 semaines. Aucun cas d'échappement virologique n'a été rapporté.
Aucun patient n'a abandonné le traitement en raison d'événements indésirables reliés
au traitement. Les effets indésirables les plus couramment rapportés dans tous les groupes de

-4-
traitement, tous génotypes confondus, étaient les suivants : céphalées (4 % dans l'ensemble,
plage de 2 à 8 % dans tous les groupes de traitement), fatigue (2 % dans l'ensemble, plage de
0 à 8 % dans tous les groupes de traitement) et nausées (2 % dans l'ensemble, plage de 2 à
8 % dans tous les groupes de traitement). Deux effets indésirables sévères, la pyélonéphrite et
le lymphome B, ont été rapportés et n'ont pas été liés au médicament à l'étude.
À propos de l'association grazoprévir/elbasvir
L'association grazoprévir/elbasvir est un traitement expérimental administré une fois
par jour renfermant du grazoprévir (inhibiteur de la protéase NS3/4A) et de l'elbasvir (inhibiteur
du complexe de réplication NS5A). Dans le cadre du vaste programme d'essais cliniques de
Merck, l'association grazoprévir/elbasvir est à l'étude dans le contexte du traitement de
l'infection par plusieurs génotypes du VHC ainsi que des patients atteints de maladies difficiles
à traiter, comme la coinfection par le VIH/VHC, les maladies rénales chroniques à un stade
avancé, les troubles sanguins héréditaires, la cirrhose et ceux suivant un traitement de
substitution aux opiacés.
À propos de l'hépatite C
L’hépatite C est une maladie hépatique chronique causée par le virus de l’hépatite C (VHC).
Environ 130 à 170 millions de personnes sont infectées par le virus de l'hépatite C dans le
monde et entre 350 000 et 500 000 personnes meurent chaque année d'une maladie liée à ce
virus. Environ 15 à 30 % des personnes présentant une infection chronique par le VHC finissent
par avoir une cirrhose en l'espace de 20 années. Environ 40 % des personnes infectées par le
VIH sont coinfectées par le VHC, et environ 40 à 50 % des utilisateurs de drogues injectables
sont infectés par le VHC.
Au Canada, on estime que 242 500 personnes sont infectées par le VHC. Environ 21 %
de ces personnes ne savent pas qu'elles sont infectées et n'ont toujours pas reçu de diagnostic.
L'engagement de Merck en matière de prise en charge du VHC
Depuis près de 30 ans, Merck joue un rôle de premier plan dans la réponse à l'épidémie
liée au VHC. Les employés de Merck sont déterminés à tirer parti de leur savoir-faire
scientifique, leurs ressources et leur présence mondiale afin d'offrir des solutions de santé
novatrices qui sauront aider les personnes infectées par le VHC de partout dans le monde.

-5-
À propos de Merck
La société Merck d’aujourd’hui est un chef de file mondial dans le domaine des soins de
santé qui œuvre au bien-être du monde. Merck est connue sous le nom de MSD à l’extérieur du
Canada et des États-Unis. Grâce à nos médicaments d'ordonnance, vaccins, traitements
biologiques, produits de santé grand public et de santé animale, nous collaborons avec nos
clients et œuvrons dans plus de 140 pays à procurer des solutions de santé novatrices. Nous
Nous démontrons également notre détermination à améliorer l’accès aux soins de santé grâce
à des politiques, programmes et partenariats d’envergure. Pour de plus amples renseignements
à propos de nos activités au Canada, visitez le site www.merck.ca.
Déclarations prospectives
Ce communiqué de presse renferme des « déclarations prospectives » (forward-looking
statements), au sens des dispositions libératoires de la Private Securities Litigation Reform Act
de 1995 des États-Unis. Ces déclarations sont fondées sur les convictions et les prévisions
actuelles de la direction de Merck et sont soumises à de nombreux risques et incertitudes. Rien
ne garantit que les produits au stade expérimental recevront les approbations nécessaires des
organismes de réglementation ou qu’ils auront un succès commercial. Si les postulats
comptables se révèlent inexacts ou en cas de risques ou d’incertitudes, les résultats réels
peuvent différer de façon appréciable de ceux que décrivent les déclarations prospectives.
Ces risques et incertitudes comprennent, sans s’y limiter, les conditions générales de
l’industrie et la concurrence, les facteurs économiques généraux, incluant les fluctuations des
taux d’intérêt et des taux de change; les effets de la réglementation de l’industrie
pharmaceutique ou des lois concernant les soins de la santé aux États-Unis et dans le monde;
les tendances mondiales à l’égard de la limitation des coûts des soins de santé; les avancées
technologiques et les nouveaux produits et brevets des concurrents; les défis liés à l’élaboration
d’un nouveau produit, ce qui inclut l’obtention de l’approbation réglementaire; la capacité de
Merck à prédire précisément les conditions de marché futures; les difficultés ou les retards de
fabrication; l’instabilité financière des économies mondiales et le risque de souveraineté; la
dépendance à l’égard de l’efficacité des brevets de Merck et des autres protections relatives
aux produits innovants; et le risque de faire l’objet d’actions judiciaires, y compris les litiges sur
les brevets, ou de mesures réglementaires.
Merck ne s'engage aucunement à publier des mises à jour de ses déclarations
prospectives, à la suite de nouvelles informations, d'événements futurs ou de quelque fait que
 6
6
1
/
6
100%