Examen, session 0 du 20/12/2012, réponses

UNIVERSITE PIERRE ET MARIE CURIE
LC204 2012-2013
EXAMEN "MISE EN SITUATION" DE CHIMIE ORGANIQUE
20 décembre 2012, session 0 - Durée de l’épreuve : 2 heures
CORRIGE de l’EXAMEN
Problème 1 (sur 12.5 au total)
1) Localiser les différents éléments stéréogènes dans l’-vétivone et donner
leurs configurations absolues. L’-vétivone est-elle une molécule chirale ?
La molécule ne possède ni plan de réflexion, ni centre
d'inversion (éléments de symétrie de deuxième ordre). Par
conséquent, la molécule n'est pas superposable à son image
dans un miroir plan et est donc chirale.
Molécule chirale + justification : (0.25)
Configuration des C* : (0.5) chaque, de la double liaison : (0.25)
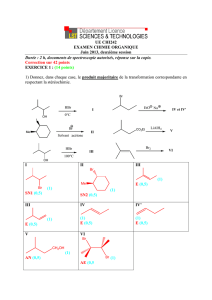
2) Séquence 1
a) donner la structure des composés 2, 4 et 7.
Chaque structure sur (0.5)
b) proposer un mécanisme pour la transformation 1 2. Donner le nom
de cette transformation.

C'est une addition nucléophile (ou cétolisation).
Mécanisme : (0.75), nom de réaction (0.25)
c) proposer un mécanisme pour la transformation 2 3. Donner le nom
de cette transformation.
Déshydratation d’un alcool (E1)
La réponse "crotonisation" est également correcte.
Mécanisme : (0.75), nom : (0.25)
d) la formation de 3 s’accompagne de celle d’un produit minoritaire noté 3’.
Proposer une structure pour ce dernier et justifier sa faible quantité.

3’ est un alcène moins substitué que 3 (règle de Zaïtsev).
3 possède un système conjugué et est stabilisé par
mésomérie.
Structure : (0.5); justification : (0.5)
e) proposer un mécanisme pour la transformation 6 7. Donner le nom
de cette transformation.
Le mécanisme global (identique sur quatre fonctions ester)
est constitué de 2 étapes : la réaction de saponification
des esters proprement dite puis la protonation de l’anion
carboxylate.
Mécanisme : (0.5), nom : (0.25)
f) proposer des conditions opératoires pour la transformation 7 8.
Quelle est le nom de cette transformation ?
Milieu acide et à chaud (0.5) : (double) décarboxylation
(0.25).
3) Séquence 2 a) donner la structure des composés 9, 12, 13 et 14.

(0.5) pour chaque structure 9, 12, 13 et (1) pour 14
b) proposer un mécanisme pour la transformation 9 10.
(1) mécanisme
c) quel est l’atome d’hydrogène le plus acide dans la molécule 10 ?
Atome localisé en de deux carbonyles : base conjuguée la plus
stable possible par mésomérie (0.5).

d) quel est l’intérêt de la transformation 11 12 ?
Protection du groupement carbonylé avant la réduction par
LiAlH4. Sans cette étape, la transformation 12 13 conduirait
à la réduction des deux fonctions ester et cétone en alcools.(0.5)
e) donner le nom des transformations 12 13 et 13 14.
12 13 : réduction (0.25) et 13 14 : oxydation (0.25)
Problème 2 (45minutes) sur 7,5 au total
1) Classer dans le composé 15 les trois types d’hydrogène Ha, Hb, Hc par
ordre d’acidité décroissante?
Ordre d’acidité décroissante Hb > Ha > Hc (0.5)
2) Donner la structure du composé 16 et donner le mécanisme de sa
formation.
O
O
O Hc
Hb
Ha
O
O
OO
O
O
O
O
O
O
O
OO
O
O
O
O
O
Base
Base
Base
O
O
O
Hb
O
O
O
EtO Ph Cl
SN2O O
O
Ph
- EtOH
16
 6
6
 7
7
 8
8
 9
9
1
/
9
100%