Examen, session 2, du 27/05/2014, réponses

UNIVERSITE PIERRE ET MARIE CURIE
LC204 2013-2014
EXAMEN DE CHIMIE ORGANIQUE
27 mai 2014, session 2 - Durée de l’épreuve : 2 heures
L’épreuve comporte deux parties indépendantes. Elles seront traitées sur deux
copies différentes. L’usage des documents et des calculatrices est interdit. Vos
copies doivent être rédigées à l'encre bleue ou noire uniquement (l’usage du
crayon à papier et d’encre rouge est interdit).
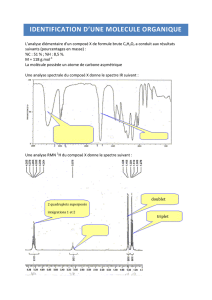
Exercice n°1
Le composé 13 peut être obtenu selon la séquence réactionnelle suivante. Nous
nous intéresserons ici à l’étude de chacune de ces étapes.
1. En milieu acide (catalytique), l’alcool 2 réagit avec l’éther vinylique 1 pour conduire
au composé 3.
1.1. La première étape du mécanisme de formation du composé 3 est une
réaction d’addition électrophile d’un proton H+ sur la double liaison de
l’éther vinylique 1, conduisant à un intermédiaire réactionnel.
m-CPBA = O
OOH
Cl
O
1
+HO
2
H+O O
3
4 (C11H20O3)
1°/ MeO MgBr
2°/ Neutralis ation
6 (C15H26O4)1°/ NaH
2°/ Br
8
H+ / H2O9 (C17H24O3)
CrO3, N
10
O11
MeO-Na+, MeOH 12 (C23H34O4)
1°/
2°/ Neutralisation
, H+13 (C23H32O3)
catalytique
m-CPBA
O O
OMe
O
O
OMe
O
H
5
7

a) Donner les deux structures limites 1’ et 1’’ permettant de
représenter cet intermédiaire réactionnel.
b) Justifier la formation d’un unique intermédiaire réactionnel lors de
cette première étape de protonation
Stabilité relative des carbocations formés après protonation de la double liaison :
c) À partir de ces résultats proposer un mécanisme complet pour cette
réaction conduisant à la formation du produit 3.
1.2. Quel est le nom de la nouvelle fonction créée dans le composé 3 ?
Fonction acétal
1.3. Le composé 3 est-il chiral ? Justifier votre réponse.
Une molécule chirale a la propriété de produire, par réflexion dans un miroir, une image non
superposable par rapport à celle d’origine. Le composé 3 ne présente aucun élément de
symétrie et possède un centre stéréogène (ici un atome de carbone lié à 4 substituant
différents). Le composé 3 est donc chiral.

1.4. Si oui, le produit 3 obtenu est-il énantiomériquement pur ?
Non. Le composé 3 est obtenu sous la forme d’un racémique (50% de chaque énantiomère)
car on observe une attaque équiprobable de la fonction alcool sur chaque face du
carbocation plan.
2. Le composé 4 de formule brute C11H20O3 est obtenu par action de l’acide méta-
chloroperbenzoïque (m-CPBA) sur le composé 3.
2.1. Donner la structure du composé 4.
2.2. Quel est le nom de la fonction formée dans le composé 4 ?
Fonction époxyde
3. L’addition nucléophile de l’organomagnésien 5 sur le composé 4 conduit après
neutralisation au produit 6 de formule brute C15H26O4.
3.1. Donner la structure du composé 6.
3.2. Justifier la régiosélectivité observée au cours de cette réaction.
L’addition nucléophile de l’organomagnésien 5 sur l’époxyde 4 a lieu selon un processus de
type SN2. On aura donc une ouverture régiosélective de l’époxyde sur le carbone le moins
substitué (le moins encombré).
4. Proposer un mécanisme permettant d’expliquer la formation du composé 8 à partir
des réactifs 6 et 7.

5. En milieu acide aqueux, le composé 8 conduit au produit 9.
5.1. Donner la structure du composé 9.
5.2. Écrire le mécanisme mis en jeu.
Mécanisme : hydrolyse d’un acétal en milieu aqueux acide avec la formation d’un dérivé
carbonyle et d’un alcool. Avec l’écriture simplifiée ci-dessus on aura :
6. En présence du réactif de Collins (CrO3 / Pyridine), le composé 9 est transformé
en 10.
6.1. De quel type de réaction s’agit-il ?
Il s’agit d’une réaction d’oxydation d’alcool primaire.
Remarque : Le réactif de Collins permet de ne pas oxyder cet alccol primaire jusqu’à l’acide
carboxyxlique correspondant (réactif plus doux que CrO3 seul).
6.2. Quel est le nom de la nouvelle fonction créée dans le composé 10 ?
Fonction aldéhyde
7. Traitée en milieu basique (MeO-Na+ dans le méthanol), la cétone 11 réagit avec le
dérivé carbonylé 10 pour conduire au produit 12 de formule brute C23H34O4.
7.1. Donner la structure du composé 12.
OOR
H+
O O
H
RO
+ ROH
O
OH
H
O O H
H
Prototropie
OOH
H
O
HO
Alcool
Dérivé carbonylé
OOH + H+

7.2. Quel est le nom de cette transformation ?
Condensation aldolique ou aldolisation
7.3. Donner le mécanisme correspondant à la formation du composé 12 à
partir des produits 10 et 11.
Soit avec l’écriture simplifiée ci-dessous :
7.4. Le composé 12 présente-t-il des centres stéréogènes ?
a) Si oui, combien ? Identifier les à l’aide d’une étoile sur une
représentation du composé 12.
Le composé 12 possède deux centres stéréogènes.
b) Si oui, combien de stéréoisomères peuvent être obtenus ?
2 centres stéréogènes d’où 22 = 4 stéréoisomères (2 couples d’énantiomères et 4
diastéréoisomères).
8. Chauffé en milieu acide, le composé 12 conduit rapidement à un nouveau produit
13 de formule brute C23H32O3.
8.1. Donner la structure du composé 13.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%