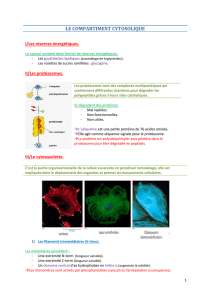
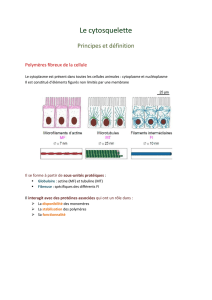
Cytosquelette

81
UE2- La cellule et les tissus
© 2012, Elsevier Masson SAS. Tous droits réservés
6
Cytosquelette
I. Organisation générale
II. Microtubules
III. Microfilaments
IV. Filaments intermédiaires
I . Organisation générale
Contrairement à l'impression de rigidité évoquée par le terme de
squelette, les trois structures qui composent le cytosquelette sont des
édifices moléculaires en perpétuel renouvellement avec un compor-
tement très dynamique et une grande plasticité structurale. Le cytos-
quelette est constitué de trois types de structures : les microtubules
(MT), les microfilaments (MF) et les filaments intermédiaires (FI).
II . Microtubules
A . Tubuline et microtubules
La sous-unité élémentaire des MT est un dimère de α et de β -tubuline
où chaque monomère présente un site de liaison nucléotidique. Le site
de la sous-unité α est bloqué sous forme GTP. L'état nucléotidique glo-
bal du dimère ne dépend que du site de β qui peut lier le GTP ou le GDP
et est qualifié d'échangeable. La β -tubuline est aussi une GTPase. Sous
forme GTP, le dimère de tubuline est rectiligne tandis que sous forme
GDP, elle présente une légère angulation.
La structure théorique formée par l'enchaînement de dimères ab-ab-ab …
est appelée protofilament . La juxtaposition latérale de 13 protofilaments
selon un arrangement cylindrique de 25 nm de diamètre forme un MT.
L'extrémité des MT qui expose des α - tubulines est appelée extrémité
moins ( − ) ; celle qui expose des β -tubulines est l'extrémité plus (+). Les
extrémités (+) et ( − ) des MT présentent des propriétés différentes.
L'extrémité (+) change de conformation selon l'état du polymère.
Un MT en phase de croissance incorpore la tubuline-GTP sous la
forme d'un feuillet dont les bords se rapprochent pour fermer le MT.
L'incorporation de nouvelles sous-unités stimule l'activité GTPase des
dimères incorporés récemment (la tubuline est sa propre GAP). Un MT
en phase de croissance présente donc au bout (+) une coiffe de tubu-
line-GTP tandis que le reste du polymère est essentiellement sous forme
GDP. Cette coiffe empêche le désassemblage spontané d'un MT. Si elle
est perdue, les protofilaments deviennent libres de se courber vers l'ex-
térieur du cylindre et de se dissocier en sous-unités de GDP-tubuline
libres ( fig.6.1A ).
0001559082.INDD 810001559082.INDD 81 8/24/2012 12:13:08 PM8/24/2012 12:13:08 PM

Structure générale de la cellule
6
82
Fig.6.1
Microtubules.
A. Assemblage et désassemblage des microtubules.
B. Organisation du centrosome et nucléation des microtubules.
0001559082.INDD 820001559082.INDD 82 8/24/2012 12:13:08 PM8/24/2012 12:13:08 PM

Cytosquelette 6
83
B . Centrosome, nucléation et élongation
des microtubules, notion de concentration critique
Dans la cellule, les MT croissent à partir de centres organisateurs, le
plus connu étant le centrosome . C'est une structure proche du noyau
qui comprend deux centrioles perpendiculaires et un matériel protéique
péricentriolaire amorphe. Un centriole est formé de neuf triplets de MT
assemblés en un supercylindre. Chaque triplet comprend un MT com-
plet (tubule A) et deux tubules incomplets (B et C) qui lui sont accolés
longitudinalement. Des liens protéiques unissent latéralement les neuf
triplets pour former le supercylindre centriolaire. Dans le matériel péri-
centriolaire , la cellule concentre des complexes de γ -tubuline organisés
en anneaux ouverts (un tour avec un décalage de trois sous-unités) qui
servent de matrice pour nucléer (= initier l'assemblage) de nouveaux
MT. Le bout ( − ) des MT est au contact de la γ -tubuline, son extrémité
(+) est donc orientée vers la périphérie cellulaire ( fig.6.1B ).
La phase de nucléation est suivie d'une phase de croissance ou d'élon-
gation . In vitro , la vitesse d'élongation de MT nucléés sur un cen-
trosome est fonction de la disponibilité de la tubuline-GTP soluble
( fig.6.2A gauche).
Remarque
À concentrations très élevées ( > 20 μ M), une nucléation spontanée donne
naissance à des MT indépendants du centrosome.
À la concentration critique , la vitesse d'assemblage nette s'annule. À
des concentrations inférieures, elle devient négative : la dilution favorise
le désassemblage des MT. Des tracés semblables peuvent être obtenus
pour les extrémités (+) et ( − ) ( fig.6.2A droite). La concentration critique
du bout (+) est plus faible que celle du bout ( − ). Dans une cellule, la
tubuline est à une concentration de 5 à 10 μ M soit entre les concentra-
tions critiques des bouts (+) et ( − ). Ceci implique que l'extrémité ( − ) de
tout MT non lié au centrosome dépolymérise, alors que son extrémité
(+) peut croître.
C . Modalités de la dynamique microtubulaire
1 . Instabilité dynamique
Le comportement des MT caractéristique de leur bout (+) est l'insta-
bilité dynamique ( fig.6.2B haut). Elle consiste en une alternance de
phases de polymérisation et de dépolymérisation qui opèrent indé-
pendamment pour chaque MT. L'historique de longueur d'un MT au
cours du temps permet de visualiser ces phases, de situer les transi-
tions (catastrophes vers le désassemblage et sauvetages vers la crois-
sance). Dans la cellule, un MT nouvellement nucléé croît sans accident
jusqu'à la périphérie cellulaire où il peut entrer en instabilité dyna-
mique pendant quelques centaines de secondes et finit par se désas-
sembler complètement. Ceci permet aux MT d'explorer le cytoplasme
en le parcourant depuis leur site de nucléation jusqu'à la périphérie
cellulaire sous la MP.
0001559082.INDD 830001559082.INDD 83 8/24/2012 12:13:09 PM8/24/2012 12:13:09 PM

Structure générale de la cellule
6
84
Fig.6.2
Propriétés des extrémités et modalités de la dynamique microtubulaire.
A. Rôle de la concentration en tubuline sur l'assemblage des microtubules et notion de concentration
critique.
B. Modalités de la dynamique microtubulaire.
0001559082.INDD 840001559082.INDD 84 8/24/2012 12:13:09 PM8/24/2012 12:13:09 PM

Cytosquelette 6
85
Remarque
Cette exploration s'effectue sans déplacement de tubuline vers la périphérie
ou vers le centre de la cellule (voir ci-dessous).
2 .
Treadmilling
La génération d'une nouvelle extrémité ( − ) libre (par détachement du
centrosome ou par coupure interne d'un MT) conduit au comporte-
ment de treadmilling qui propage un MT vers la périphérie cellulaire
( fig. 6.2B bas). De nouvelles sous-unités de tubuline incorporées au
bout (+) à un instant t0 vont se trouver dans le corps du MT à t1 et libé-
rées par dépolymérisation du bout ( − ) à t3. Parallèlement, le MT pro-
gresse vers la périphérie cellulaire sans déplacement net des sous-unités
de tubuline dans le cytoplasme. Elles sont juste passées transitoirement
par un état polymère. Le terme treadmilling s'applique aux MT mais
caractérise aussi le comportement de certaines protéines régulatrices de
la dynamique associées au bout (+) des MT en croissance.
D . Protéines se liant aux microtubules
La dynamique des MT résulte des propriétés intrinsèques de la tubu-
line. Dans la cellule cependant, ce comportement est amplifié et régulé
par de nombreuses protéines associées aux MT. Parmi ces microtubule-
associated proteins (MAPs) , on distingue des MAPs structurales qui
copolymérisent avec la tubuline, des protéines qui se lient transitoire-
ment au bout (+), les plus-end tracking proteins (+TIPs) et des moteurs
moléculaires capables de se déplacer le long des MT.
1 . MAPs et +TIPs
Les MAPs structurales liées à la surface du MT stabilisent le polymère. Ces
protéines comme MAP1 , MAP2 , MAP4 ou tau présentent un domaine
d'interaction avec la tubuline et un domaine qui se projette perpendicu-
lairement à la surface des MT et qui prévient leur rapprochement trop
important. La cellule module la liaison des MAPs à la surface des MT par
phosphorylation (inhibitrice) et déphosphorylation ( fig.6.3A ). Si la phos-
phorylation est excessive comme avec tau dans la maladie d'Alzheimer ,
une déstabilisation délétère des MT peut se produire.
Les +TIPs sont des protéines qui font pour la plupart du treadmil-
ling à l'extrémité des MT et régulent leur comportement dynamique.
Certaines opèrent pendant la croissance, d'autres pendant la dépoly-
mérisation. Certaines +TIPs sont des régulateurs de la dynamique qui
peuvent stimuler la croissance (EB1 ), d'autres peuvent aider à stabiliser
les MT ou à capturer leur extrémité en croissance en périphérie cellu-
laire ; certaines favorisent les catastrophes et stimulent la dépolyméri-
sation tandis que d'autres sont des facteurs de sauvetage (CLIP-170 ).
2 . Moteurs moléculaires
Les moteurs moléculaires transforment l'énergie issue de l'hydrolyse de
l'ATP en mouvement pour assurer un déplacement orienté vers le bout
( − ) ou le bout (+) des MT (voir fig.6.3A ). Les moteurs transportent
0001559082.INDD 850001559082.INDD 85 8/24/2012 12:13:13 PM8/24/2012 12:13:13 PM
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%









![III - 1 - Structure de [2-NH2-5-Cl-C5H3NH]H2PO4](http://s1.studylibfr.com/store/data/001350928_1-6336ead36171de9b56ffcacd7d3acd1d-300x300.png)