Le compartiment cytosolique1.16 MB

1
LE COMPARTIMENT CYTOSOLIQUE
I/Les réserves énergétiques.
Le cytosol contient deux formes de réserves énergétiques:
- Les gouttelettes lipidiques (assemblage de triglycérides).
- Les rosettes de sucres ramifiées : glycogène.
II/Les protéasomes.
III/Le cytosquelette.
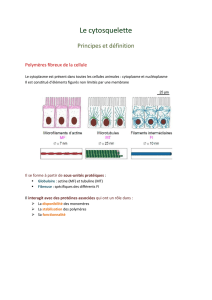
C’est la partie organisationnelle de la cellule eucaryote en perpétuel remodelage, elle est
impliquée dans le déplacement des organites et permet les mouvements cellulaires.
1) Les filaments intermédiaires (8-10nm).
Les monomères possèdent :
- Une extrémité N-term (longueur variable).
- Une extrémité C-term (longueur variable).
- Un domaine central d’aa hydrophobes en hélice α (augmente la solidité).
Les monomères sont activés par phosphorylation (cytosol) ou farnésylation (nucléoplasme).
Les protéasomes sont des complexes multiprotéiques qui
contiennent différentes chambres pour dégrader les
polypeptides grâces à leurs sites catalytiques.
Ils dégradent des protéines:
- Mal repliées.
- Non fonctionnelles.
- Non utiles.
L’ubiquitine est une petite protéine de 76 acides aminés.
Elle agit comme séquence signale pour le protéasome.
La protéine est polyubiquitinyler puis pénètre dans le
protéasome pour être dégradée en peptides.

2
Formation spontanée d’un dimère par deux monomères de même sens.
Assemblage en tétramère par deux dimères antiparallèles.
Alignement des tétramères en fibre pour obtenir un protofilament.
L’association de huit protofilaments forme un filament intermédiaire.
Le desmosome :
- Jonction entre deux cellules (par la mbp).
- Retrouvé dans les kératynocytes et les cellules épithéliales.
Les FI de cytokératine sont reliés au cadhérines desmosomales par les plakoglobines.
Il existe quatre familles de filaments intermédiaires :
- Lamines : soutient de l’enveloppe nucléaire.
- Vimentine :
Vimentine : cellules mésenchymateuses.
Desmine : tissu musculaire lisse et squelettique.
GFAP : glie du système nerveux (cellule de Schwann).
- Cytokératine : cellules épithéliales (cohésion tissulaire).
- Neurofilaments : neurones du SNC et SNP.
Leurs propriétés :
- Durables.
- Moins dynamique que les polymères globulaires.
- Forment la lamina nucléaire.
- Pas d’intervention de ribonucléotide.
Ils jouent un rôle architectural.
2) Les microfilaments d’actine.
Les monomères :
- Protéine de base : actine G (globulaire).
- Trois types d’actines :
α surtout dans les cellules musculaires.
β et γ dans les autres types cellulaires.
Il y a des échanges entre les monomères à ADP et à ATP pour la polymérisation.

3
La polymérisation :
- Activation de l’actine G par fixation à l’ATP.
- Association de plusieurs monomères pour former un polymère d’actine F (filamentaire).
- L’assemblage de deux actines F forme un microfilament en torsade (structure régulière).
Le microfilament est polarisé : + = grande vitesse de polymérisation ; - = faible vitesse de
polymérisation.
Organisation des MF en réseau : association à la filamine.
Organisation des MF en faisceaux : association avec l’α-actinine (muscle) et la villine (microvillosité).
Les interactions des MF d’actine :
- Jonction serrée : interactions cellule-cellule qui rapproche les deux membranes.
- Jonction intermédiaire : interaction lâche par les cadhérines (activée par le Ca2+).
- Contacts focaux : interaction cellule-matrice par les intégrines.
Les MF ne s’attachent jamais directement à la membrane mais toujours par des protéines
d’association (CAM = molécule d’adhésion cellulaire).
Les rôles des MF d’actine :
- La contraction musculaire : liée par la présence de la myosine II à activité ATPasique.
- La division cellulaire.
- Stabilisation de la cellule.
- Modification de la forme cellulaire.
C’est une structure très dynamique qui s’est assez bien conservée au cours de l’évolution.
Les étapes de la polymérisation :
- Nucléation : association des monomères (processus lent).
- Polymérisation : ajout rapide de monomères pour compenser la perte d’actine G.
- Equilibre : diminution de la vitesse de polymérisation et la [actine G] (concentration critique).
La dépolymérisation se fait par l’hydrolyse d’ATP qui dissocie les interactions entre monomères.

4
3) Les microtubules.
La polymérisation :
- Auto-assemblage de tubuline α et β associée au GTP pour être active.
- Association de plusieurs dimères pour former un protofilament rectiligne.
- Association en décalage hélicoïdal de 13 protofilaments pour obtenir un microtubule.
Les MT polymérisent à partir du centrosome et colonisent tout le cytoplasme.
L’extrémité + du MT est tournée vers la périphérie et à une polymérisation rapide.
L’extrémité – du MT est tournée vers le noyau et à une polymérisation lente.
Pour fixer la structure la β s’associe au GTP-γS qui empêche l’hydrolyse du GTP.
Les propriétés :
- C’est une structure dynamique en constant remaniement.
- Ils sont organisés en faisceaux.
- Stabilisés par les protéines Tau, Map 2 et le taxol.
La dépolymérisation se fait par la stathmine qui hydrolyse le GTP et libère les monomères de
tubuline α et β-GDP.
Les protéines associées au MT (MAP) :
- MAP 2 : une tête qui s’associe à 3 tubulines et la queue à un autre MT.
- Tau : association des MT dans l’axone.
- Kinésine : transport vers l’extrémité + par activité ATPasique.
- Dynéine : transport vers l’extrémité – par activité ATPasique.
Le MT n’est pas capable de s’associer à des structures sans protéines associées.
4) Les centrioles.
Le centrosome est :
- La base de nucléation des MT (COMT).
- Un ensemble de protéines situées près du noyau.
- Constitué de deux structures :
Deux centrioles.
Placés perpendiculairement = diplosome.
Constitués de tubuline α et β.
Contient 9 triades de 3 MT.
Une matrice protéique : formée par des MAP et la tubuline γ.
Les MT s’organisent au niveau du COMT à partir de l’anneau de tubuline γ à la surface du COMT.

5
1
/
5
100%