Prolapsus rectal: mise à jour

1029
CURRICULUM
Prolapsus rectal: mise à jour
Céline Duvoisin Cordoba, Nicolas Demartines, Dieter Hahnloser
Service de chirurgie viscérale, Centre hospitalier universitaire vaudois, Lausanne
Le prolapsus rectal (PR) est une pathologie relativement
peu fréquente mais très invalidante qui peut se présenter
sous forme d’une simple protrusion en passant par un
saignement anal, une constipation chronique, et jusqu’à
l’incontinence aux selles. Le PR nécessite très souvent
un traitement chirurgical.
Cet article a pour but de passer en revue la pathologie
d’un PR et de servir de guide pour permettre le diagnos-
tic, choisir les investigations utiles et conseiller aux pa-
tients les différents traitements possibles. Pratiquement:
– quels sont les symptômes?
– quels sont les examens utiles?
– quels sont les différents traitements?
Une question de dénition:
prolapsus rectal complet
Le PR complet se dénit par la protrusion de toutes les
couches du rectum au travers de l’anus (g. 1 et 2 ).
Il se manifeste par une extériorisation des anneaux
concentriques de la muqueuse rectale. Son incidence
est de 0,25–0,45% dans la population adulte. Sa préva-
lence est estimée à 1% des adultes au-delà de 65 ans, soit
2,5 nouveaux cas pour 100 000 habitants chaque année
[1]. Les femmes représentent 80–90% des patients.
Cette pathologie est connue depuis les civilistions égyp-
tiennes et grecques, et la plus ancienne référence se
trouve dans le Papyrus Ebers 1500 avant J.-C. Hippo-
crate a décrit un traitement original en proposant de
suspendre le patient par les pieds et de le secouer pour
réduire le prolapsus. Une fois le PR réduit, il a proposé
d’appliquer de la soude caustique sur la muqueuse pen-
dant trois jours. Les premières publications modernes
remontent à 1888 où Mikulicz a popularisé l’amputation
du PR par voie périnéale, puis Moschcowitz l’a faite par
voie abdominale en 1912. Durant le XXe siècle, de mul-
tiples techniques ont été décrites, par voies abdominales
et périnéales [2].
Les facteurs de risques décrits sont le genre féminin, la
multiparité, les accouchements par voie basse, et l’âge
au-dessus de 40 ans. La constipation chronique, les
pathologies psychiatriques et les antécédents de chirurgie
pelvienne font également partie des facteurs de risque.
Dans la littérature, une étude bien conduite en contredit
une autre en ce qui concerne le mécanisme physio-
pathologique du PR. On ne met pas en évidence une
cause unique, mais plusieurs explications sont possibles
[2]. Si la pathogénie demeure incertaine, les anomalies
anatomiques constitutives du PR sont bien connues. Il
s’agit de l’insufsance de xation postérieure du rec-
tum, de la longueur excessive du recto-sigmoïde, d’un
cul-de-sac de Douglas anormalement profond, du dia-
stasis des muscles releveurs de l’anus, et de la faiblesse
du sphincter anal.
Prolapsus rectal incomplet (interne)
ou intussusception
Le PR incomplet consiste en une procidence de la mu-
queuse uniquement, ou un prolapsus de la paroi rectale
ne s’extériorisant pas au-travers de l’anus. On l’appelle
PR occulte ou intussusception. On suppose que l’évolu-
tion naturelle de l’intussusception est le PR complet. En
pratiquant une sélection prudente des patients, le fait
d’opérer les intussusceptions symptomatiques pourrait
prévenir leur évolution en PR complet. Par la suite, cet
article se concentre uniquement sur le PR complet ou
externe.
A la consultation
Les symptômes du PR complet peuvent être insidieux, et
mimer ceux du cancer rectal: l’apparition d’une masse,
réductible ou non, de rectorragies, d’un inconfort abdo-
minal, d’une sensation de vidange rectale incomplète,
d’un transit altéré, d’une extériorisation de mucus ou
d’une incontinence aux selles. Les premiers symptômes
sont la protrusion d’une masse dans le canal anal avec
décharge de mucus, souvent en association avec la défé-
Quintessence
• Le prolapsus rectal (PR) est une pathologie invalidante, apparaissant
typiquement chez la femme âgée.
• Il est important de différencier cliniquement un PR d’un autre trouble
de la statique pelvienne tel qu’un rectocèle, un cystocèle ou un prolapsus
hémorroïdaire (ou anal) car les traitements sont différents.
• L’anamnèse gynécologique et urologique font partie de la consultation
ainsi que l’évaluation du degré d’incontinence ou de constipation.
• Malgré tout, la chirurgie reste le traitement de choix et les taux de réci-
dive varient selon la technique et l’abord. La tendance actuelle est d’effec-
tuer une rectopexie antérieure selon D’Hoore, par laparoscopie, avec d’ex-
cellents résultats à court terme.
• Une récidive de prolapsus rectal est mieux traitée par un abord ab-
dominal.
Les auteurs ne
déclarent aucun
soutien nancier ni
d’autre conit
d’intérêt en
relation avec cet
article.
Forum Med Suisse 2013;13(50):1029–1032

CURRICULUM
Forum Med Suisse 2013;13(50):1029–1032 1030
cation. Plus tard, quand le PR s’installe, le patient peut
présenter une incontinence aux gaz, puis aux selles. L’ap-
parition de saignements est souvent associée à un pro-
lapsus de longue date. Le patient doit parfois effectuer
une manœuvre digitale pour l’intérioriser. Le PR n’est
habituellement pas douloureux, mais il y a des excep-
tions.
Plus de 50% des patients avec un PR ont une incontinence
associée [3]. 15–65% ont une constipation associée [4,
5]. Cette dernière est principalement liée à une difculté
d’exonération des selles, mais peut également résulter
d’un temps de transit augmenté. Chez 8–27% des pa-
tients, le PR est associé à d’autres troubles de la sta-
tique pelvienne. 58% des patients opérés d’un PR ont
une incontinence urinaire associée et 24% ont un pro-
lapsus génital associé. Ces symptômes requièrent une
éva luation globale, et potentiellement une prise en
charge chirurgicale multidisciplinaire [6]. Discuter de
ceci serait trop long dans le cadre de cet article mais
pour ces cas on relèvera l’importance de l’anamnèse et
de l’examen clinique du patient an de ne pas opérer
un prolapsus génital puis quelques mois plus tard un
prolapsus rectal (ou vice versa).
Si le PR est réduit, l’examen externe peut ne rien mon-
trer de particulier. On demande alors au patient de pous-
ser comme pour aller à selle. Si le prolapsus n’est pas
évident, le patient est prié de s’asseoir sur une chaise per-
cée ou aux toilettes et de patienter jusqu’à procidence
de celui-ci. Le toucher rectal est indispensable, il permet
de détecter une faiblesse sphinctérienne, une masse ou
une autre pathologie pelvienne (rectocèle, cystocèle, pro-
lapsus utérin).
Investigations fonctionnelles
Le PR est souvent associé à d’autres pathologies telles
que le rectocèle, cystocèle, entérocèle ou prolapsus utérin.
C’est pourquoi il est important d’évaluer les patients cli-
niquement et de s’aider de moyens diagnostiques tels que
la défécographie ou défécographie-IRM et, selon les cas,
d’un transit colique. La présence d’une constipation peut
avoir un impact signicatif sur le choix de la technique
opératoire. Un US endoanal et pelvien est un moyen peu
coûteux d’évaluer les dyssynergies pelviennes.
Une colonoscopie doit absolument être effectuée avant de
corriger un PR pour tout patient de plus de 50 ans ou
présentant les facteurs de risques habituels, ceci an
d’exclure d’autres pathologies telles qu’une lésion tumo-
rale ou une sténose diverticulaire qui modieraient le
choix de la technique chirurgicale [7].
Des évaluations comme la manométrie anale, l’électro-
myographie et l’évaluation du temps de latence du nerf
honteux ne sont pas utiles dans la prise en charge du PR.
La manométrie anale peut détecter des faiblesses sphinc-
tériennes mais celles-ci ont tendance à s’améliorer après
correction du PR. Elle ne détermine donc pas l’approche
chirurgicale [8]. Chez les patients incontinents, le sphinc-
ter anal commence à regagner du tonus un mois après
l’opération et la continence est généralement restaurée
en 2–3 mois [9].
Tr aitement médicamenteux-conservateur
Le traitement médicamenteux du PR complet est utile
pour minimiser les symptômes chez des patients qui ont
trop de comorbidités pour une chirurgie (ce qui est très
rare aujourd’hui), ou qui ne souhaitent pas se faire opé-
rer. Le but est d’améliorer la qualité de vie de ces per-
sonnes. Il faut s’assurer de la prise sufsante de bres
et d’eau, avec éventuellement un apport supplémentaire
de bres per os (25–30 g au total par jour) pour régula-
riser le transit. La physiothérapie pelvienne par biofeed-
back peut améliorer les symptômes. Le biofeedback n’est
pas décrit comme un bon moyen thérapeutique mais
il est utilisé principalement pour améliorer la fonction
postopératoire [10–12].
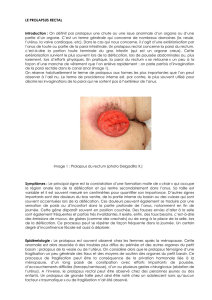
Figure 1
Prolapsus rectal complet.
Figure 2
Diagnostic différentiel: prolapsus hémorroïdaire (ou anal).

CURRICULUM
Forum Med Suisse 2013;13(50):1029–1032 1031
Tr aitement en urgence
La plus importante complication liée au PR complet non
opéré est l’incarcération. Le traitement consiste à placer
le patient en position de Trendelenburg, puis à appli-
quer des compresses froides ou du sucre jusqu’à ce que
l’œdème diminue et qu’une réduction manuelle devienne
possible [13]. En cas d’échec, une intervention en ur-
gence est indiquée. Le traitement consiste alors souvent
en une rectosigmoïdectomie par voie périnéale selon
Altemeier [14].
Tr aitement chirurgical en électif
Le but du traitement chirurgical est de contrôler le pro-
lapsus, restaurer la continence et minimiser la consti-
pation. Le débat actuel se porte sur l’abord (périnéal ou
abdominal), et sur la technique utilisée, notamment l’uti-
lité d’un let ou non.
Abord chirurgical: périnéal ou abdominal?
En général, l’abord périnéal a de meilleurs résultats en
termes de morbidités et douleurs postopératoires et
offre un temps d’hospitalisation réduit par rapport à un
abord abdominal. Malgré cela, il faut prendre en consi-
dération que les taux de récidives sont trois à quatre
fois plus élevés dans un abord périnéal [15, 16]. Cette
approche est souvent indiquée chez le patient âgé ou à
hauts risques anesthésiques. Par ailleurs, il est possible
d’effectuer un abord périnéal sous anesthésie locale ou
locorégionale, permettant une prise en charge éventuel-
lement ambulatoire ou un retour à domicile dans les
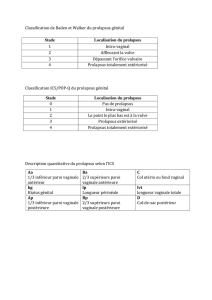
24 heures (tab. 1 ) [17].
Abords périnéaux
Technique de Delorme
Décrite par Delorme en 1900, elle implique la séparation
de la muqueuse de la sous-muqueuse ainsi que la plica-
ture de la muscularis propria. Elle a l’avantage de pou-
voir exciser un ulcère rectal concomitant, si présent. La
mortalité est de 0–4% et les taux de récurrence varient
entre 0 et 16% (suivi moyen de 12–228 mois) [18, 19].
Rectosigmoïdectomie selon Altemeier
Décrite par Miles en 1933 puis remise à jour par Alte-
meier en 1971, elle implique une excision de toute la
paroi rectale avec, si possible, une partie du sigmoïde,
en effectuant une anastomose colo-anale. La mortalité
est de 0–5%, et les taux de récidives entre 12,5 et 37%
(suivi moyen 11–47 mois) [18, 19].
Perineal Stapled Prolapse Resection (PSP)
Décrite par Scherer en 2008, cette technique consiste en
une résection rectale par agrafage de toute la paroi
à l’aide d’une agrafeuse circulaire. Le temps opératoire
moyen est réduit par rapport à d’autres techniques et
les résultats montrent une nette diminution de l’inconti-
nence postopératoire [20, 21]. Le suivi à long terme est
encore inconnu en 2013.
Abords abdominaux
Bien que similaires entre elles, les techniques par voie
abdominale diffèrent par certains aspects. Une revue de
littérature publiée par Cochrane Library a conclu qu’il
n’y avait pas encore de preuves sufsantes qu’une tech-
nique serait meilleure qu’une autre [22]. L’hétérogénéité
des études disponibles rend leurs interprétations dif-
ciles. Le choix de la technique n’a pas montré d’inuence
sur le taux de récidive soit 1% à 1 an, 6,6% à 5 ans,
28,9% à 10 ans [23].
Deux principales techniques sont décrites: la rectopexie
postérieure comme préconisée par Wells, Orr-Loygue ou
plus récemment la rectopexie antérieure selon D’Hoore
et la rectopexie avec résection sigmoïdienne. La résection
sigmoïdienne augmente la morbidité liée au geste et n’est
indiquée qu’en cas de constipation chronique. La ten-
dance actuelle est d’effectuer une rectopexie antérieure
par laparoscopie selon d’Hoore [24]. Plusieurs études ont
montré un très bon résultat de cette technique par rap-
port aux taux pré-postopératoires d’incontinence (amé-
lioration des symptômes chez 85% des patients) et de
constipation pré-postopératoire (amélioration chez 72%)
avec un taux de récidives égal voire inférieur à d’autres
techniques soit de 2–4,7% [25, 26]. Différents types de
lets sont utilisés, absorbables ou non, avec des résul-
tats similaires [18]. L’utilisation d’une prothèse biolo-
gique semble aussi efcace qu’une prothèse synthétique
[24].
Toutes les techniques chirurgicales de rectopexie ab-
dominale peuvent être effectuées par laparoscopie avec
des résultats similaires. Le temps d’hospitalisation est si-
gnicativement plus court, le temps opératoire plus long.
Ta bleau 1
Avantages et désavantages des différentes techniques chirurgicales.
Te chnique chirurgicale Avantages Désavantages, risques Récidive
Perinéal
Delorme Anesthésie
loco-régionale
Récidives élevées,
constipation
15–30%
Altemeier Anesthésie
loco-régionale
Excision du rectum
± sigmoïde «à l’aveugle»,
insufsance anastomo-
tique
15–30%
PSP Court temps
opératoire
Coûts élevés (agrafeuse) inconnu
Abdominale
Rectopexie antérieure
(D’Hoore)
Restaure l’anatomie
(aussi du compar ti-
m ent antérieur),
petit risque de
lésions des nerfs
Utilisation matériel
étranger
2–5%
Rectopexie postérieure Meilleure évaluation Lésions de nerfs 2–10%
a vec résection
sigmoïdienne
Amélioration
d’une constipation
si présente
Morbidité augmentée 10–15%
par laparoscopie Douleurs moindres,
court temps
hospitalier
––
assisté du robot Facilite les sutures
et protège mieux
les nerfs
Coûts –

CURRICULUM
Forum Med Suisse 2013;13(50):1029–1032 1032
Les patients bénécient surtout d’un meilleur contrôle
de la douleur, et d’une reprise de transit plus rapide
[27]. La faisabilité d’un abord laparoscopique a été dé-
montrée même chez des patients à hauts risques. Les
complications mineures sont signicativement moins
nombreuses [28].
Abords combinés
Peu d’études existent ayant combiné le traitement d’un
PR et d’un prolapsus génital. Certaines proposent un
abord abdominal simul-
tané en effectuant une
colpo-hysteropexie asso-
ciée à une résection sig-
moïdienne, d’autres pro-
posent une colpopexie
plus une rectopexie avec
let, ou enn une hystérectomie vaginale suivie d’un Al-
temeier. Les approches sont variables et les séries très
limitées [2].
Etudes en cours
A ce jour, une seule étude randomisée comparant les
abords périnéaux vs abdominaux a été publiée en 1994
[24]. L’ étude DeloRes en cours, une étude multicentrique
randomisée, compare le Delorme vs rectopexie avec ré-
section sigmoïdienne. Ses résultats devraient être publiés
prochainement.
Le PROSPER trial, étude multicentrique randomisée de
grande ampleur, compare les voies d’abords (abdo-
minale vs périnéale) et les procédures (rectopexie vs
rectopexie avec résection et Altemeier vs Delorme). Mal-
heureusement, elle n’a montré aucune différence signi-
cative entre les différentes randomisations [30].
Le prolapsus rectal récurrent
Dans une étude rétrospective sur le PR comprenant
685 patients, le taux de récidives moyen, tous types de
chirurgie confondus, est de 13,1% avec un intervalle
moyen de 33 mois dont un tiers dans les 7 premiers mois
post-chirurgie. Cette étude a également démontré que le
taux de seconde récidive est plus élevé en utilisant une
approche périnéale pour corriger le PR récurrent (37,3
vs 14,8%; p = 0,03). Malgré le manque d’études rando-
misées prospectives sur ce sujet, il semble préférable
d’utiliser une approche abdominale en cas de PR récur-
rent [31].
Conclusion
Le PR est une pathologie peu fréquente mais nécessite
une prise en charge adéquate an de minimiser les
risques de récidives. La première étape consiste en une
anamnèse et un status détaillés an de mettre en évi-
dence d’autres troubles de la statique pelvienne. Peu
d’examens complémentaires sont utiles hormis la colo-
noscopie, la défécographie ou déféco-IRM et éventuelle-
ment l’US endoanal. Par
la suite, choisir l’abord
et la technique chirur-
gicale an de minimiser
les complications et les
risques de récidives peut
être difcile et dépend de
l’expérience du chirurgien. Quand cela semble néces-
saire, celui-ci est amené à se référer à un centre spécia-
lisé pour une approche multidisciplinaire.
Correspondance:
Prof. Dieter Hahnloser
CHUV
Service de chirurgie viscérale
BH10-206
Rue du Bugnon 46
CH-1011 Lausanne
dieter.hahnloser[at]chuv.ch
Références
La liste complète des références se trouve sous www.medicalforum.ch.
Le diagnostic est posé
sur l’examen du patient,
idéalement en position
assise
Le prolapsus rectal est
souvent accompagné d’une
incontinence fécale et/ou
constipation
1
/
4
100%