TD 9 - OM complexes eleve

TD 9 :
Orbitales moléculaires
Exercice 1. Complexe Ni(NH
3
)
6
2+
.
On donne ici les orbitales moléculaires du bloc d du complexe Ni(NH
1. Le ligand NH
3
est-
il σ donneur
2.
Proposer une identification pour les orbitales ci
ou antiliant.
Exercice 2. Complexe Cr(CO)
6
1.
Rappeler la structure de Lewis de CO. Par quel atome ce ligand peut
2. Quel e
st le degré d’oxydation du chrome dans ce complexe
3. Comment pouvez-
vous qualifier le ligand CO
est-
il faible ou important avec ce ligand
du bloc d p
our ce complexe. Est
Exercice 3. Complexe Cu(H
2
O)
6
2+
.
1.
Rappeler la couleur d'une solution aqueuse de Cu(H
d'absorption est-
il attendu sur le spectre UV
On considère
dans un premier temps que le ligand H
est octaédrique.
2.
Donner la diagramme d'OM de Cu(H
3.
Expliquer le terme σ-
donneur.
En réalité une analyse du c
omplexe montre que sa géométrie est déformée. Les distances métal
axiales sont plus longues que les longueurs métal
cartésienne où l'axe z est suivant les ligands axiaux. Cette déformation est prou
par un épaulement présent dans le spectre UV
4.
Montrer que l'ordre énergétique des orbitales du bloc d du complexe est modifié par la
déformation axiale et qu'une levée de dégénérescence supplémentaire apparaît.
5.
Montrer que l'octaèdre déformé est plus stable dans le cas de Cu(H
régulier. C'est l'effet
Jahn Teller
6.
Expliquer en quoi l'étude spectroscopique de Cu(H
Jahn-Teller.
7.
Le complexe Ni(H
2
O)
6
2+
présente
Orbitales moléculaires
des complexes
On donne ici les orbitales moléculaires du bloc d du complexe Ni(NH
3
)
6
2+
.
il σ donneur
? π donneur ou accepteur ?
Proposer une identification pour les orbitales ci
-
dessus, et donner leur caractère liant, non liant
Rappeler la structure de Lewis de CO. Par quel atome ce ligand peut
-
il se coordiner au métal
st le degré d’oxydation du chrome dans ce complexe
?
vous qualifier le ligand CO
? L’écart énergétique entre les orbitales du bloc d
il faible ou important avec ce ligand
? En déduire le remplissage électronique des orbitales
our ce complexe. Est
-il para ou diamagnétique ?
Rappeler la couleur d'une solution aqueuse de Cu(H
2
O)
6
2+
. A quelle longueur d'onde le maximum
il attendu sur le spectre UV
-visible ?
dans un premier temps que le ligand H
2
O est simplement σ-
donneur et que le complexe
Donner la diagramme d'OM de Cu(H
2
O)
6
2+
et représenter les orbitales du « bloc d » de ce complexe.
donneur.
omplexe montre que sa géométrie est déformée. Les distances métal
axiales sont plus longues que les longueurs métal
–
ligand équatoriales. On travaille dans une base
cartésienne où l'axe z est suivant les ligands axiaux. Cette déformation est prou
vée expérimentalement
par un épaulement présent dans le spectre UV
-visible de Cu(H
2
O)
6
2+
.
Montrer que l'ordre énergétique des orbitales du bloc d du complexe est modifié par la
déformation axiale et qu'une levée de dégénérescence supplémentaire apparaît.
Montrer que l'octaèdre déformé est plus stable dans le cas de Cu(H
Jahn Teller
.
Expliquer en quoi l'étude spectroscopique de Cu(H
2
O)
6
2+
permet de mettre en évidence l'effet
présente
-t-il également un effet Jahn-
Teller ? Justifier.
dessus, et donner leur caractère liant, non liant
il se coordiner au métal
?
? L’écart énergétique entre les orbitales du bloc d
? En déduire le remplissage électronique des orbitales
. A quelle longueur d'onde le maximum
donneur et que le complexe
et représenter les orbitales du « bloc d » de ce complexe.
omplexe montre que sa géométrie est déformée. Les distances métal
– ligand
ligand équatoriales. On travaille dans une base
vée expérimentalement
Montrer que l'ordre énergétique des orbitales du bloc d du complexe est modifié par la
déformation axiale et qu'une levée de dégénérescence supplémentaire apparaît.
Montrer que l'octaèdre déformé est plus stable dans le cas de Cu(H
2
O)
6
2+
que l'octaèdre
permet de mettre en évidence l'effet
Teller ? Justifier.

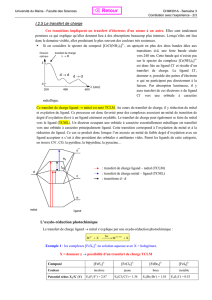
Exercice 4. Complexation de H
2
1. Le bloc d du diagramme d’OM d’un fragment ML
5
de géométrie pyramidale à base carrée avec
M au milieu de la base est obtenu à partir du fragment ML
6
, avec L ici un ligand uniquement σ
donneur. Commenter l’évolution du diagramme entre les deux géométries.
Pour la suite, on négligera l’orbitale moléculaire issue de d
x²-y²
, trop haute en énergie pour intervenir
avec les autres orbitales étudiées ici.
2. Proposer un diagramme d’OM issu de l’interaction entre le fragment ML
5
et une molécule de
dihydrogène tels que représentés ci-dessous. On considèrera que les OM du bloc d du fragment
ML
5
qui nous intéressent ici sont situées entre les deux niveaux d’énergie des OM de H
2
.
M L
L
L
L
L
HH
x
z
y
3. Analyser les transferts électroniques entre M et H
2
sur l’exemple d’un complexe où le métal est
d
6
. Que peut-on en conclure sur la liaison H
2
quand la molécule est coordinée au métal ?
M L
L
L
L
L
L
M L
L
L
L
L
1
/
2
100%