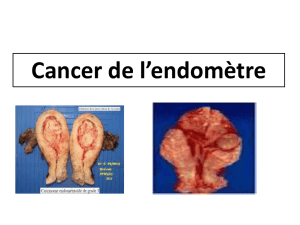
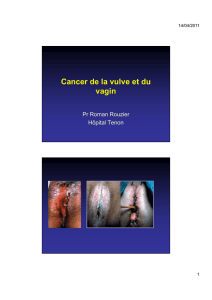
Lymphadénectomie inguinale dans le cancer du pénis : techniques

◆TECHNIQUE CHIRURGICALE Progrès en Urologie (1997), 7, 665-673
665
Lymphadénectomie inguinale dans le cancer du pénis :
techniques chirurgicales et indications
Olivier BOUCHOT, Patrice BOULLANGER, Jean-Marie BUZELIN
Clinique Urologique, CHU Nantes, France
RESUME
L’envahissement ganglionnaire est un des facteurs
pronostiques majeurs du cancer du pénis. Son éva-
luation clinique et paraclinique étant difficile, la
lymphadénectomie inguinale, voire ilio-inguinale,
garde des indications. Cette chirurgie présentant
une morbidité certaine (nécrose des berges cutanées,
infection, lymphorrhée et lymphœdème d'appari-
tion plus tardive), les indications sont présentées en
fonction de l’existence ou non d’adénopathies ingui-
nales palpables et du stade de la tumeur primitive.
Différentes techniques chirurgicales sont proposées:
lymphadénectomie inguinale superficielle et profon-
de en cas d’adénopathies inguinales palpables et
mobiles, lymphadénectomie inguinale simplifiée et
superficielle en l’absence d’adénopathie inguinale
palpable et en cas de tumeur primitive infiltrante.
Mots clés : Pénis, cancer, ganglions, lymphadénectomie.
Progrès en Urologie (1997), 7, 665-673.
L'épithélioma spino-cellulaire, ou carcinome épider-
moïde, est une lésion rare en oncologie urologique.
Cette tumeur se développe à partir d'un épithélium
malpighien , et se caractérise par son potentiel d’exten-
sion rapide essentiellement par voie lymphatique.
Chez l’homme, cette tumeur se développe au niveau:
[1] du pénis avec une incidence en Europe de 0,6 à 1
pour 100.000 patients, [2] de l'urètre, dont seulement
1200 cas ont été rapportés dans la littérature, nombre
certainement sous-estimé, dont 50 à 75% sont locali-
sées au niveau de l'urètre bulbaire [1]. Chez la femme,
elle peut être retrouvée au niveau des deux tiers dis-
taux de l'urètre et au niveau de la vulve.
L'épithélioma spino-cellulaire du pénis, outre l'enva-
hissement de contiguïté, va se propager par voie vas-
culaire et surtout par voie lymphatique vers les gan-
glions inguinaux. Ce drainage préférentiel, initiale-
ment décrit par R
O U V I È R E
en 1938, a été confirmé
par lymphographie pénienne [7]. Le traitement de
cette tumeur dépend pour une large part de la pré-
sence ou non de métastases ganglionnaires. Leur
diagnostic clinique est difficile du fait de l’existence
d’envahissement infra-clinique, d’adénites liées à la
surinfection de la tumeur primitive, et de l’obésité
fréquente des patients. Les examens paracliniques
classiques (lymphographie pédieuse, tomosensito-
métrie, imagerie par résonance magnétique) ne sont
d’aucune aide pour cette évaluation, du fait d’une
sensibilité et d’une spécificité très faibles. Ces insuf-
fisances font qu’il existe une place pour la lympha-
dénectomie inguinale dans les tumeurs du pénis, ce
d’autant que ce geste a une valeur thérapeutique. Les
controverses sur la place de la lymphadénectomie
inguinale sont nombreuses, liées à la morbidité de
cette chirurgie.
Les publications récentes ont permis de définir plus
précisément la place des techniques de lymphadénec-
tomie inguinale, d’en diminuer la morbidité.
Manuscrit reçu : janvier 1997, accepté : juin 1997.
Adresse pour correspondance : Pr.O. Bouchot, Clinique Urologique, CHU Hôtel-
Dieu, BP 1005, 44035 Nantes.
Figure 1. Voies d’abord proposées pour une lymphadénecto -
mie inguinale ou ilio-inguinale.

666
TECHNIQUES CHIRURGICALES
La réalisation d'une lymphadénectomie inguinale dans
le cadre d'un épithélioma spino-cellulaire du pénis a
pour objectif l'ablation des relais lymphatiques ingui-
naux susceptibles d’être envahis. Si l'on se place dans
une stratégie de traitement curatif en cas d’adénopa-
thie(s) palpable(s), cette lymphadénectomie inguinale
peut être superficielle et profonde, bilatérale et précédée
d'un curage ganglionnaire iliaque externe [1]. En l’ab-
sence d’adénopathie palpable, la lymphadénectomie
peut être limitée aux ganglions inguinaux superficiels.
La lymphadénectomie inguinale reste une chirurgie
difficile car :
- de pratique peu courante;
- minutieuse dès sa voie d'abord (Figure 1) (Tableau 1)
- l'apparition d'une complication précoce en postopératoi-
re (nécrose cutanée, infection, lymphorrhée, lymphocèle)
augmente la durée d'hospitalisation et d'invalidité. Il
importe de ne pas négliger le lymphœdème du membre
i n f é r i e u r, complication tardive, invalidante et compromet-
tant la réintégration sociale du patient (Tableau 2).
Préparation et installation du patient
La veille de l'intervention :
- mise en route d'un traitement anticoagulant et d'une
antibiothérapie non spécifique
- après tonte et désinfection cutanée large, mettre en
place des bas de contention parfaitement adaptés aux
mensurations des membres inférieurs du patient.
Installation
Le patient est installé en décubitus dorsal, avec légère
abduction et rotation externe de la cuisse pour exposer
le triangle fémoral.
Lymphadénectomie inguinale superficielle et pro-
fonde par voie horizontale (Gibson)
Les limites anatomiques de cette chirurgie sont: en avant
le fascia superficialis, en haut le ligament inguinal, en
dehors le bord antéro-interne du muscle Sartorius, en
dedans le bord antéro-externe du muscle moyen adduc-
t e u r, en bas l'apex du triangle fémoral, et en arrière le
plan antérieur du pédicule fémoral (Figure 2).
Tableau 1. Comparaison entre 3 types d’incision concernant le nombre de ganglions enlevés, la durée d’hospitalisation et le temps
opératoire d’après Ornellas [23].
Nombre de Incision NombreNombre de ganglions Hospitalisation Temps
patients d’incisions prélevés (jours) opératoire
21 Bi-iliac 21 25 54 4 h 30
29 S-shaped 58 23 50 5 h 00
ilioinguinal (AA)
18 S-shaped 36 21 36 4 h 30
inguinal
14 Gibson 28 37 23 6 h 30
ilioinguinal (DD-D’D’)
30 Gibson 57 24 16 4 h 50
inguinal (D’D’)
Tableau 2. Morbidité de la lymphadénectomie ilio-inguinale ou inguinale en fonction de la voie d’abord utilisée [23, 27].
Auteurs Nombre de Incision NombreNécrose Infection Lymphorrhée Lymphoedème
patients cutanée d’incisions cutanée % % % %
Ornellas [23] 21 Bi-iliac 21 82% 09%
47 S-shaped (AA) 94 72% 4% 32%
44 Gibson (D’D’) 85 5% 15% 9% 16%
Ravi [27] Verticale (EE) 57 18% 40% 5% 21%
Inguinale seule Gibson (D’D’) 38 18% 42% 5% 24%
T-shaped (CCC’) 136 19% 74% 5% 27%
Ilioinguinale Verticale (EE) 48 10% 69% 12% 21%
S-shaped (AA) 44 16% 82% 9% 30%
Skin-bridge (DD-D’D’) 44 16% 80% 8% 34%
T-shaped (CCC’) 875% 100% 25% 62%

La lymphadénectomie inguinale est réalisée par une
incision cutanée horizontale, parallèle au pli inguinal, 3
cm en dessous. En cas de lymphadénectomie iliaque
associée, la technique du "skin-bridge" de FRALEY et
HUTCHENS [11] est préférable. Ce type d'incision aug-
mente la durée opératoire mais permet de diminuer le
nombre de nécrose cutanée. En effet, BARONOFSKY,en
1948, a montré que la vascularisation de la peau, mince
à ce niveau, et du tissu adipeux sous-cutané, était hori-
zontale [2]. Ainsi s'expliquent les pourcentages élevés
de nécrose des berges cutanées observées en cas d'inci-
sion verticale qui interrompt cette vascularisation.
La peau fine avec un mince pannicule adipeux ne doit
pas être traumatisée, l'exposition se faisant à l'aide de
fils tracteurs passés au niveau du fascia superficialis.
Le décollement, sous le fascia superficialis, permet
d'exposer la grande veine saphène (Figure 3). Outre
cette veine qui traverse l’aponévrose sous le ligament
inguinal pour s’aboucher dans la veine fémorale, le
tissu cellulaire sous-cutané contient :
- quatre artères, issues de l’artère fémorale: la sous-
cutanée abdominale en haut et en dedans, la circon-
flexe iliaque superficielle en haut et en dehors, les hon-
teuses externes supérieure et inférieure transversales en
dedans;
- les nerfs superficiels du triangle fémoral;
- les ganglions lymphatiques inguinaux superficiels,
dont le nombre varie de quatre à vingt, groupés en un
amas triangulaire, inscrit dans le triangle fémoral
(Figure 4). Deux lignes, l'une verticale, l'autre horizon-
tale se croisant à l'embouchure de la grande veine
saphène, les divisent en quatre groupes: supéro-interne,
supéro-externe, inféro-interne, inféro-externe. Les gan-
glions des groupes supérieurs ont, en général, leur
grand axe parallèle au ligament inguinal; les ganglions
des groupes inférieurs sont, au contraire, allongés de
haut en bas. Les ganglions des groupes supérieurs
reçoivent les lymphatiques de la paroi abdominale, de
la fesse, du périnée, de l'anus, du scrotum, et du pénis
chez l'homme. Les ganglions des groupes inférieurs
reçoivent les lymphatiques du membre inférieur. Des
ganglions superficiels partent des vaisseaux efférents
qui vont aux ganglions inguinaux profonds et aux gan-
glions iliaques externes.
Dans un premier temps, il est plus facile de délimiter la
lymphadénectomie: en dehors, incision de l’aponévro-
se du muscle sartorius sur son bord antéro-interne; en
dedans, incision de l’aponévrose du muscle moyen
adducteur sur son bord antéro-externe; en haut, exposi-
tion du ligament inguinal.
La lymphadénectomie est commencée en haut et en
dedans au niveau du ligament inguinal. Le tissu cellu-
lo-graisseux est disséqué prudemment sous ce ligament
jusqu'au plan postérieur formé à ce niveau par la veine
fémorale. Au bord interne de la veine fémorale, deux à
trois ganglions profonds sont présents. L'un d'eux, le
ganglion de Cloquet, est situé à l'anneau fémoral, entre
la veine fémorale et le bord externe du ligament de
Gimbernat. Ils reçoivent une partie des vaisseaux effé-
rents des ganglions inguinaux superficiels et des troncs
collecteurs lympha
tiques profonds du membre inférieur,
montent en avant et sur les côtés des vaisseaux fémoraux.
667
Figure 2. Comparaison des limites anatomiques d’une lym -
phadénectomie inguinale classique (ligne pointillée) et de la
lymphadénectomie modifiée par Catalona (traits) [9].
Figure 3. Exposition du plan superficiel de la lymphadénecto -
mie inguinale.

Les canaux lymphatiques doivent être ligaturés et non
coagulés, l'efficacité de l'électrocoagulation sur les
vaisseaux lymphatiques n'excédant pas 10 jours. En
dehors de la veine, le plan postérieur est formé de l'ar-
tère fémorale. Les branches de l'artère sont immédiate-
ment rencontrées. Il est préférable de conserver les
artères supérieures, sous-cutanée abdominale et cir-
conflexe iliaque superficielle, d'où partent les vais-
seaux à destination cutanée afin d'éviter une nécrose
(Figure 4). Néanmoins, si le curage est techniquement
difficile, leur ligature peut s'avérer nécessaire.
En dehors de l'artère, le nerf fémoral doit être protégé.
La dissection se poursuit en dehors vers l'épine iliaque
permettant de découvrir l'origine de muscle sartorius et
de compléter, si nécessaire, la limite externe du curage.
La totalité du tissu cellulo-graisseux est mise en trac-
tion, la dissection vers l'apex se faisant en suivant le
plan postérieur formé par le pédicule fémoral.
L'exérèse s'effectue sur l'adventice des vaisseaux, mais
il n'est pas nécessaire de les disséquer, aucun élément
ganglionnaire ne se trouvant à leur face postérieure. La
grande veine saphène est ligaturée puis sectionnée au
niveau de sa terminaison.
L'apex du triangle fémoral est facilement repéré. Les
canaux lymphatiques présents au niveau de l'apex doi-
vent être soigneusement ligaturés en dedans du plan de
la grande veine saphène. L'ouverture de l'aponévrose
du muscle sartorius en dehors et de l'aponévrose du
muscle moyen adducteur en dedans permet de bien
délimiter cette zone et de ne pas oublier un vaisseau
lymphatique. L'ensemble du tissu cellulo-graisseux est
enlevé, permettant de vérifier soigneusement l'hémo
-
stase et la lymphostase.
La fermeture doit répondre a 2 objectifs:
1. éliminer les espaces morts créés par la lymphadé-
nectomie. S’y associe :
2. la transposition du muscle sartorius: l'origine du
muscle, disséquée lors de la lymphadénectomie, est
sectionnée. La vascularisation de ce muscle est préser
-
vée, assurée par des branches de l'artère quadricipitale
qui abordent le muscle par sa face postérieure, 8 à 10
cm sous son origine. Le muscle doit être suffisamment
668
Figure 5. Distribution des branches artérielles provenant de
l’artère fémorale au niveau du creux inguinal.
Figure 4. Anatomie du tissu cellulaire sous-cutané de la région inguinale d’après Sobotta [29].

disséqué pour que la transposition puisse se faire sans
tension. Il est suturé au ligament inguinal par des points
séparés de fil non résorbable (Figure 6).
- l'utilisation d'un film de colle biologique permettant
d'appliquer le tissu cutané sur le plan musculaire
(Figure 7) et évitant le drainage aspiratif, source de
lymphorrhée [5].
- assurer une suture cutanée sans tension.
Le pansement est sec et non compressif.
En post-opératoire:
La technique chirurgicale seule est insuffisante pour
prévenir ces complications précoces. La qualité des
soins post-opératoires et la coopération du patient sont
indispensables. Ils nécessitent :
- le maintien du décubitus dorsal strict et l'absence de
flexion prolongée de la cuisse pendant 5 jours;
- la recherche et l'évacuation systématique de petites
collections hématiques et/ou lymphatiques;
- la reprise progressive de l'orthostatisme à partir du
6ème jour postopératoire, en proscrivant la station assi-
se pendant 15 jours;
- la poursuite du traitement anticoagulant pendant 10
jours;
- le maintien impératif des bas de contention pendant
les 3 premiers mois.
Lymphadénectomie inguinale modifiée par
CATALONA [9]
CATALONA a proposé en 1988 de réaliser une lympha-
dénectomie inguinale limitée aux ganglions inguinaux
superficiels et profonds situés au dessus et en dedans
de la jonction entre la grande veine saphène et la veine
fémorale (Figure 2) [9].
L’incision cutanée est également horizontale. Les
limites sont: le muscle oblique externe en haut, le bord
externe de l’artère fémorale en dehors, la crosse de la
grande veine saphène et la partie inférieure de la fos-
sette ovale en bas, et en dedans le muscle moyen
adducteur (Figure 2).
La dissection est débutée vers le haut sous le fascia
superficialis, permettant d’isoler le groupe supéro-
interne des ganglions inguinaux superficiels, et de
prendre contact avec le ligament inguinal et le muscle
oblique externe au dessus du cordon spermatique.
Vers le bas, la grande veine saphène est repérée, dissé-
quée, et seules les veines qui y convergent sont ligatu-
rées. La grande veine saphène est respectée et conser-
vée afin d'assurer un meilleur retour veineux. Par
contre, la jonction saphéno-fémorale doit être soigneu-
sement disséquée afin d’enlever tous les ganglions du
groupe médian des ganglions inguinaux superficiels.
Latéralement, la lymphadénectomie va en dedans jus-
qu’au muscle moyen adducteur, par contre en dehors
elle ne dépasse pas le bord externe de l’artère fémorale.
Au niveau des chaînes inguinales profondes, seuls les
ganglions présents sur la face antérieure et latéro-inter-
ne de la veine fémorale sont retirés, la dissection
remontant jusqu’au ligament inguinal.
Lors de la fermeture, il n’est pas nécessaire de réaliser
de transposition musculaire. Les auteurs mettent en
place un drain aspiratif dans l’espace de décollement
avec réalisation de compression périodique pour facili-
ter l’évacuation de collections liquidiennes. Ce draina-
ge est maintenu environ une semaine. Mais ce draina-
ge peut être remplacé par l’application de tissu colle
comme précédemment décrit.
669
Figure 6. Fermeture - Transposition du muscle sartorius.
Figure 7. Fermeture - Modification proposée avec vaporisation
d’un film de colle de fibrine entre le plan musculaire (muscle
sartorius) et le tissu cellulaire sous-cutané.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%