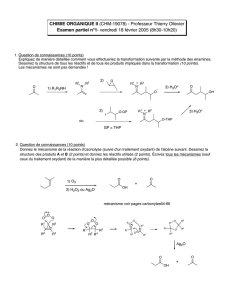
Chimie Organométallique

Chimie et Matériaux Inorganiques
9 – Chimie Organométallique
Catalyseur de Sir G. Wilkinson, prix Nobel de Chimie 1973

9 - Chimie Organométallique
I. Chimie Organométallique
1. Une brève histoire de la chimie organométallique
2. Etudier la chimie organométallique
3. Règle des 18 électrons
4. Nature de la liaison M-C
II. Etapes élémentaires du cycle catalytique
1. Addition oxydante
2. Elimination réductrice
3. Insertion-Migration
4. Eliminations
5. Un peu d’exercice…
III. Les principaux types de complexes organométalliques
1. Propriétés périodiques
2. Classement selon les ligands
a. Carbonyles
b. Alcènes
c. Cyclopentadiènes
d. Phosphines
e. Hydrures

I – Chimie organométallique
Chimie organométallique = compréhension de la catalyse au niveau moléculaire
Composés organométalliques = contiennent au moins une liaison M-C
Rh
H
CO
PPh3
PPh3
RPt
R
R
PMe3
PMe3

I.1. – Brève histoire de la chimie organométallique
1840 : Bunsen découvre et goûte les « alkarsines »
1852 : Frankland découvre
les composés zinciques
et mercuriques
1901 : Grignard découvre les composés
magnésiens. Nobel de Chimie 1912
1930 : Gilman découvre les composés
cuprolithiens
1943 : Rochow découvre une synthèse des chlorosilanes
et permet la production industrielle des silicones

Brève histoire de la chimie organométallique des métaux de transition
1827 : Sel de Zeise, Na[PtCl3C2H4)]
1er composé organométallique synthétisé
permet de mettre en évidence les notions de
mécanisme « push-pull »
et d’
hapticité
(nombre d’atomes du ligand coordinés)
1938 : Roelen met au point la réaction d’hydroformylation
1951 : Paulson et Kealy découvre le ferrocène
Sa structure « sandwich » est établie par
Woodward et Wilkinson en 1952
1955 : Ziegler et Natta découvre une famille
de catalyseurs qui permettent la polymérisation
de l’éthylène et du propylène.
RR
O
HR
O
H
cat
CO, H2linéaire branché
Co
OC H
OC
OC CO
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
1
/
49
100%