Galien exercice 5 - mars 2010

Exercice n°5
- 1 –
INTERNAT PHARMACIE
EXERCICE N°5
40 POINTS
Date : Samedi 20 mars 2010 & Dimanche 21 mars 2010

Exercice n°5
- 2 –
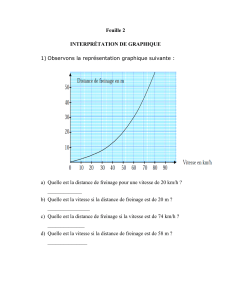
Question n°1 : Calculer l’alcoolémie théorique d’un homme de 85kg, après ingestion de deux verres de
20cL de punch à 18°.
Données : Masse volumique de l’éthanol : 0,8g/mL
Teneur en eau totale de l’organisme : 60%
L’alcool se répartit dans tous les secteurs hydriques de l’organisme
Question n°2 : Comparer à la valeur théorique calculé chez une femme de 60kg ayant absorbé la même
quantité d’alcool.
La distillation de l’alcool est effectuée sur une prise d’essai de 10mL de sang, en présence de 50mL d’acide
picrique. On recueille environ 30mL de distillat dans une fiole jaugée de volume U=50mL et on ajuste au
trait de jauge avec de l’eau distillée.
Dans un erlen, on introduit :
• Distillat E=20ml
• Dichromate de potassium + acide nitrique 20mL
Après 30 minutes d’obscurité, on ajoute
• Eau distillée 50mL
• Iodure de potassium 10mL
Après 1 minute à l’obscurité, on verse du thiosulfate de sodium de concentration molaire exactement
connue (C = 0,051M). Soit Ve le volume versé. On réalise un témoin ; soit Vt le volume versé.
Question n°3 : Quel est le nom de la méthode utilisée ? En décrire le principe et donner les différentes
équations bilan.
Question n°4 : Etablir l’expression littérale permettant de calculer l’alcoolémie (en g/L) en fonction de C,Ve
et Vt (unités précisées).
Question n°5 : Sachant que pour une alcoolémie de 0,75g/L, on a trouvé Vt=19,95mL, quelle est la valeur
de la chute de burette Ve.
Question n°6 : Quelle est la valeur maximale de l’alcoolémie que l’on peut déterminer avec ce protocole ?
Comment le modifier pour doser un échantillon plus concentré en alcool ?

Correction exercice n°5 - toxicologie
- 1 –
CORRECTION
INTERNAT PHARMACIE
EXERCICE N°5
TOXICOLOGIE
Date : Samedi 20 mars 2010 & Dimanche 21 mars 2010

Correction exercice n°5 - toxicologie
- 2 –
Question n°1 : Calculer l’alcoolémie théorique d’un homme de 85kg, après ingestion de deux verres de
20cL de punch à 18°.
Données : Masse volumique de l’éthanol : 0,8g/mL
Teneur en eau totale de l’organisme : 60%
L’alcool se répartit dans tous les secteurs hydriques de l’organisme
Le volume hydrique total chez cet homme est :
La quantité d’éthanol pur ingérée est
L’alcoolémie est donc de
!
57,6g
51L=1,13g.L"1
Question n°2 : Comparer à la valeur théorique calculé chez une femme de 60kg ayant absorbé la même
quantité d’alcool.
Le volume hydrique chez cette femme est de 36L, son alcoolémie est donc de 1,60g.L-1
NB : A poids égal, l’alcoolémie chez la femme est majorée car l’enzyme dégradant l’éthanol est légèrement
moins efficace que chez l’homme.

Correction exercice n°5 - toxicologie
- 3 –
La distillation de l’alcool est effectuée sur une prise d’essai de 10mL de sang, en présence de 50mL d’acide
picrique. On recueille environ 30mL de distillat dans une fiole jaugée de volume U=50mL et on ajuste au
trait de jauge avec de l’eau distillée.
Dans un erlen, on introduit :
• Distillat E=20ml
• Dichromate de potassium + acide nitrique 20mL
Après 30 minutes d’obscurité, on ajoute
• Eau distillée 50mL
• Iodure de potassium 10mL
Après 1 minute à l’obscurité, on verse du thiosulfate de sodium de concentration molaire exactement
connue (C = 0,051M). Soit Ve le volume versé. On réalise un témoin ; soit Vt le volume versé.
Question n°3 : Quel est le nom de la méthode utilisée ? En décrire le principe et donner les différentes
équations bilan.
La méthode utilisée est la méthode officielle avec oxydation nitrochromique dite Méthode de Cordebard :
Elle consiste en une séparation de l’éthanol par distillation en présence d’acide picrique (action défécante
et anti-mousse) et recueille du distillat.
Ensuite, l’éthanol est dosé en utilisant ses propriétés réductrices vis-à-vis d’une solution nitrochromique à
froid et en excès. L’excès d’oxydant est dosé en retour par iodométrie. Un essai à blanc doit être pratiqué
en parallèle (remplacement du distillat par de l’eau distillée)
La méthode est longue, utilise beaucoup de sang (5mL) et demeure peu spécifique.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%