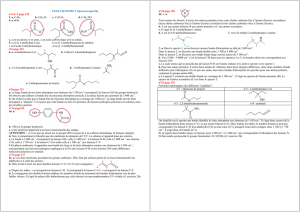
TP Spectroscopie Infrarouge - Chimie TS

Chap4 : Analyse spectrale
TP 8
Spectroscopie infrarouge
Objectifs:
Identification de liaisons à l’aide du nombre d’onde correspondant; détermination de groupes
caractéristiques. Mise en évidence de la liaison hydrogène.
Exploiter un spectre IR pour déterminer des groupes caractéristiques à l’aide de tables de données
ou de logiciels.
Associer un groupe caractéristique à une fonction dans le cas des alcool, aldéhyde, cétone, acide
carboxylique, ester, amine, amide.
Dans tout le TP, on utilisera le logiciel Specamp, et son module "Spectroscopie IR" pour répondre aux
questions.
I. Principe de la spectroscopie IR :
1. Modes de vibrations :
- Qu’est-ce qu’une vibration moléculaire ?
- Qu’exploite la spectroscopie IR ?
- Visualiser les différents modes de vibration et les décrire.
2. Etude par fonction :
- Relever les bandes caractéristiques d'élongation des quelques fonctions organiques suivantes.
- Préciser l’unité du nombre d’onde.
Liaison
O-H
Alcool
lié*/
libre**
C=O
Ester
C=O
Cétone
OH
acide
carboxylique
C=O
acide
carboxylique
C=O
aldéhyde
C-H
alcane
C=O
Amide
N-H
Amine
Bande d’
absorption
* lié : présence de liaisons hydrogène (par exemple en solution). ** libre : absence de liaisons hydrogène
(par exemple pour un gaz).
Info : On peut considérer deux grandes régions dans un spectre IR :
La région 4000 – 1500 cm-1 : c’est celle qui nous intéresse car elle contient les bandes de vibration de
valence correspondant aux principaux groupements
La région 1500 – 600 cm-1 : cette région très complexe est appelée empreinte digitale de la molécule.
Cette région permet d’identifier, par comparaison avec un spectre de référence, le composé analysé.
3. Analyse du spectre de l'éthanol :
Charger IR éthanol dans OH.
- Relever les nombres d’onde des différentes bandes observées et les décrire (bande large/fine,
intensité forte/moyenne/faible).
- Conclure en s’aidant du tableau précédent.
II. Comparaison de spectres IR :
1. Analyse de spectres et mise en évidence de fonctions :
Charger les spectres de la propanone (acétone), du propanal et propan-1-ol.
- Pour chaque molécule, donner sa formule brute, son groupe caractéristique et ses bandes
d'absorption.
- Les comparer 2 par 2 (sinon le 3ème apparaît à côté)
- Conclure.
2. Etude de la liaison C=O :
Charger les spectres de l’acide butanoïque, de l’acétate d’éthyle, de la butan-2-one et de la
butanamide (attention se trouve dans un fichier différent).
- Pour chaque molécule, donner sa formule brute, son groupe caractéristique et la bande
d'absorption de la liaison C=O
- Conclure.

3. Etude de la liaison O-H :
Charger les spectres de l’éthanol à l’état gazeux (pas de liaison hydrogène) – (attention se trouve
dans un fichier différent) et à l’état liquide (présence de liaisons hydrogène).
- Quelles conséquences sur le spectre entraine les liaisons hydrogène établies entre les molécules
d’alcool ?
III. Détermination de molécules :
La procédure est la suivante :
En cliquant sur "Attribution spectre – formule", trouver la bonne molécule.
IV. Conclusion :
Bande de O-H
vers 3300 cm-1
?
Bande de N-
H2 vers 1600
cm-1 ?
Bande de
C=O vers
1700 cm-1 ?
2
bandesà2710
et 2850 cm-1
?
Bande O-H
entre2500 et
3500 cm-1 ?
Bande de C-O
vers 1200 cm-1
?
Bande de N-
Hentre3100 et
3500 cm-1 ?
Aldéhyde
Acide
carboxylique
Ester
Amide
Alcool
Amine
Non
Non
Non
Non
Non
Oui
Oui
Oui
Oui
Oui
Oui
Oui

Chap4 : Analyse spectrale
TP 8
Spectroscopie
Correction
I. Principe de la spectroscopie IR :
1. Modes de vibrations :
- Qu’est-ce qu’une vibration moléculaire ? Chaqueatome lié par une liaison covalente peut
légèrement se déplacer par rapport aux autres atomes, puis revenir à sa position. Tous les
atomes vibrent donc en permanence, et par conséquent une molécule aussi.
- Qu’exploite la spectroscopie IR ? Elle exploite les modes de vibration des liaisons covalentes au
sein d'une molécule. Chaque vibration correspond à une énergie bien précise. Quand cette
énergie est envoyée, sous forme d'une radiation IR, à la molécule étudiée, celle-ci absorbe cette
radiation, ce qui se traduit par un pic d'absorption sur le spectre.
- Visualiser les différents modes de vibration et les décrire.Il y a 6 modes possibles : 2 vibrations
d'élongation (symétriques et antisymétriques) et 4 vibrations de déformation (rotation,
cisaillement, balancement et torsion).Voir les vibrations.
2. Etude par fonction :
Liaison
O-H
Alcool
lié /libre
C=O
Ester
C=O
Cétone
OH
acide
carboxyliqu
e
C=O
acide
carboxyliqu
e
C=O
aldéhyd
e
C-H
alcane
C=O
Amide
N-H
Amine
Bande d’
absorption
en cm-1
3200 à 3500
/
3600 à 3700
1730
à
1750
1660
à
1725
2500
à
3340
1710
à
1760
1720
à
1740
2850
à
2950
1650
à
1680
1560
à
1640
Remarque : les valeurs diffèrent selon les tables.
3. Analyse du spectre de l'éthanol :
- Relever les nombres d’onde
Intenses: 3330 cm-1, large ; 2976,
fine ; 1089, fine ; 1048, fine
Moyennes : 1380 cm-1, large ; 882,
fine.
- Conclure
La bande de l’alcane est présente à
2885 cm-1. La bande de la fonction
OH est présente à 3330 cm-1. La
bande à 2976 cm-1 peut
correspondre au OH d'un acide
carboxylique, mais la liaison C=O
entre 1710 et 1760 n'est pas
présente. Il s'agit donc d'un alcool.
II. Comparaison des spectres IR :
1. analyse de spectres et mise en évidence de fonctions :
Propanone (acétone) :
CH3-CO-CH3
Groupe : -CO-
Bandes* : 1715 (cétone) ;
3004 ; 3414 cm-1
Propanal :
CH3- CH2-CHO
Groupe : -CHO
Bandes* : 1736 à 1768
(aldehyde) ; 2720 ; 2806 ;
2916 ; 2997 ; 3470 cm-1

* Pour des nombres d'onde >
1500 cm-1
Propan-1-ol :
CH3- CH2-CH2OH
Groupe : -OH
Bandes* : 3350 (alcool) ;
2975 ; 2944 ; 2886 ; 1551
cm-1
Les spectres sont donc différents selon les molécules. Mais chaque fonction est représentée par une bande
d'absorption caractéristique.
2. Etude de la liaison C=O :
Acide butanoïque :
CH3-(CH2)2- COOH
Groupe : -COOH
Bande C=O : 1714 cm-1
Acétate d'éthyle :
CH3- COO-CH2- CH3
Groupe : -COO-
Bande C=O: 1733cm-1
Butan-2-one :
CH3-CO-CH2-CH3
Groupe : -C=O
Bande C=O : 1718 cm-1
Butanamide :
CH3-(CH2)2-CONH2Groupe :
-CON
Bande C=O: 1662 et 1631
cm-1
3. Etude de la liaison O-H : Sans liaisons hydrogène,
bande fine à 3674 cm-1.
Avec liaisons hydrogène,
bande large à 3328 cm-1.
Donc la bande de la fonction
OH est déplacée selon qu'il y
ait ou non des liaisons
hydrogène.
III. Conclusion :La spectroscopie IR permet d'identifier des groupes caractéristiques dans une molécule,
mais pas la molécule complète.

Nom du professeur :
N Massé
Matière :
Chimie
Classe :
T S
Salle :
Date de restitution de cette fiche au
technicien :
Date :
Horaires :
Nombre
d’élèves/binômes* :
14
Technicien préparateur exposé :
TP /
Expérience
prof *
Titre
TP 8 : Spectroscopie IR
Quantité :
Besoins en matériel:
Salle info avec Specamp
Fichiers supplémentaires à ajouter
Nom des Produits
chimiques
Concentration et volume
total demandés
Phrase de
risque et de
sécurité
Produit
dangereux ?
(art R4411.6)
Recherche
de
substituant ?
Protections :
◊ Gants
◊ Lunettes
◊ Hotte
◊Masques
Déchets chimiques : (Cocher les cases correspondantes et préciser le volume estimé)
◊ Composés organiques non chlorés
NB : Merci de bien vouloir remettre cette fiche 7 jours avant au technicien de laboratoire.
1
/
5
100%